El colágeno, siendo la proteína más abundante presente en nuestro organismo, juega un papel crucial en la integridad de la piel, los huesos, los ligamentos y los tendones. Es el cimiento que sostiene nuestra estructura corporal y nos permite movernos con flexibilidad y fuerza.
En este artículo, profundizaremos en la importancia del colágeno y su impacto en nuestro rendimiento durante el entrenamiento. Exploraremos los diferentes tipos de colágeno presentes en nuestro cuerpo, con énfasis en el colágeno tipo I, que desempeña un papel vital en el tejido óseo, muscular y conectivo. También analizaremos cómo el consumo de colágeno dietético puede ser un aliado valioso en circunstancias de alta demanda, como el entrenamiento intenso.
Si deseas potenciar tus resultados físicos y cuidar tus tejidos de manera efectiva, acompáñanos en este viaje para descubrir el poder del colágeno y cómo puedes integrarlo de forma inteligente en tu rutina diaria. ¡Prepárate para alcanzar un nuevo nivel de bienestar y desempeño atlético!
Colágeno en el cuerpo humano: Tipos y funciones
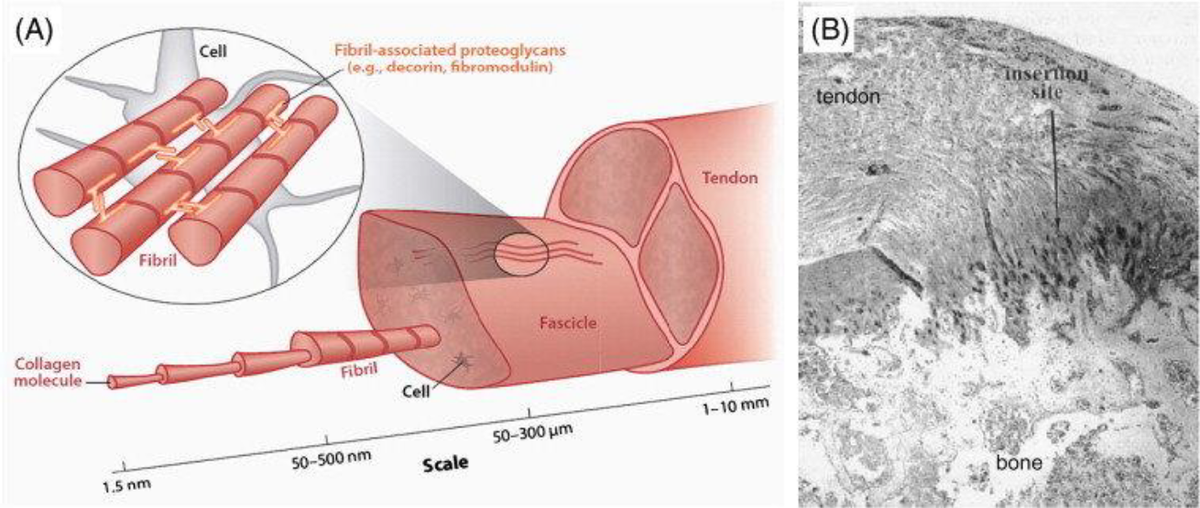
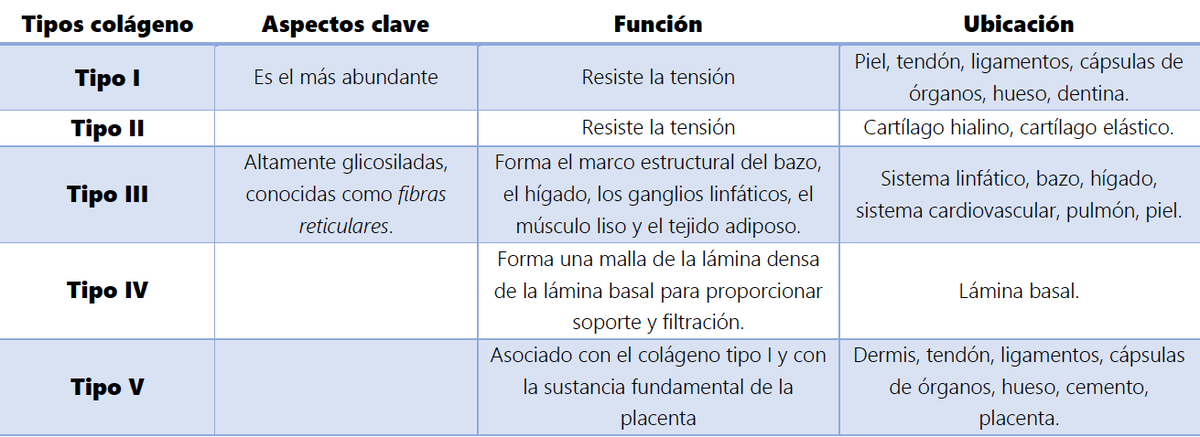
El colágeno, una proteína esencial, desempeña un papel central en el tejido conectivo extracelular del cuerpo humano, brindándole cualidades elásticas y fortaleza (Figura 1). Esta proteína es crucial para transmitir la fuerza contráctil a los tendones y huesos, permitiendo el funcionamiento óptimo del músculo esquelético. Además, las proteínas del tejido conectivo exhiben una notable capacidad de remodelación y adaptación a las necesidades del organismo. En este artículo, exploraremos los diferentes tipos de colágeno presentes en nuestro cuerpo y profundizaremos en sus funciones esenciales.El colágeno es una proteína omnipresente en varios tejidos, constituyendo aproximadamente entre el 25% y el 30% de todas las proteínas corporales. Se han identificado al menos 28 tipos diferentes de proteínas de colágeno [1]. En el tejido musculoesquelético, los tipos de colágeno I, II, III y IV son especialmente abundantes [2]. Cada tipo de colágeno comparte una secuencia similar de triple hélice derecha, compuesta por 3 cadenas α de péptidos (conjunto de aminoácidos), sin embargo, cada uno tiene funciones específicas (ver Tabla 1). Destaca que las proteínas de colágeno contienen altas concentraciones de glicina (~ 33%), prolina (~ 10%) e hidroxiprolina (~ 13,5%) debido a la secuencia de péptidos repetidos, en comparación con otras proteínas.
Tabla 1. Subtipos de colágeno, función y ubicación anatómica [3].
Originalmente, se pensó que el colágeno era inerte y resistente a la remodelación, sin embargo, la evidencia más reciente ha demostrado que las redes de colágeno y las proteínas de tejido conectivo en diversos tejidos están en un constante estado de remodelación [4-6].
La remodelación del colágeno está regulada por la síntesis de proteínas del colágeno, la degradación de las proteínas del colágeno y la actividad de reticulación (enzimática y no enzimática). La actividad física aumenta de manera potente las tasas de síntesis del tejido conectivo, lo que conduce a una remodelación mejorada y a una transferencia más eficaz de fuerza contráctil [7-10]. Por otro lado, la inactividad física reduce las tasas de síntesis del tejido conectivo [11,12], algo que puede conducir a cambios estructurales en los tejidos que comprometen sus propiedades mecánicas y contribuyen al desarrollo de lesiones.
Por ejemplo, tendones y músculos inactivos y mayores (edad) contienen más colágeno fibroso y mayor reticulación, lo que contribuye a una mayor rigidez muscular. Esto supone un deterioro en la contractilidad de las fibras musculares (funcionalidad reducida), comprometiendo la transmisión de la fuerza y reduciendo también sus niveles [13-16].
Con estas últimas investigaciones en mente, se hace evidente la importancia de entender y promover la adecuada remodelación del colágeno, tanto para optimizar el rendimiento físico como para prevenir el deterioro muscular en diversas etapas de la vida. La influencia del colágeno en la funcionalidad y salud de nuestros tejidos continúa sorprendiéndonos, y su conocimiento nos brinda una poderosa herramienta para cuidar y potenciar nuestro bienestar físico a lo largo del tiempo.
En el proceso de envejecimiento o la inactividad física, los tendones y músculos pueden experimentar cambios significativos en su composición de colágeno fibroso y mayor reticulación. Estos cambios conllevan a una mayor rigidez muscular, lo que se traduce en un deterioro en la contractilidad de las fibras musculares y una reducción en la transmisión de la fuerza. A través de este artículo, descubre cómo el colágeno juega un papel fundamental en el mantenimiento de la salud muscular y el rendimiento a lo largo del tiempo. Exploraremos cómo podemos abordar estos desafíos para mantener nuestros músculos en óptimas condiciones y disfrutar de una vida activa y plena en todas las etapas de la vida.
2. Entrenamiento como estímulo principal. Carga mecánica.
La importancia del entrenamiento como estímulo principal para estimular la síntesis de colágeno en nuestros tejidos conectivos no puede subestimarse. Estudios han demostrado que la carga mecánica es clave para desencadenar una respuesta aguda en los fibroblastos, aumentando la síntesis de colágeno [17]. Estos fibroblastos, dispuestos longitudinalmente a lo largo de las fibras de colágeno, están en constante comunicación con la matriz extracelular a través de las integrinas, lo que los expone a las fuerzas transmitidas tanto del músculo como de la matriz extracelular [17]. Al detectar esta carga mecánica, los fibroblastos regulan positivamente los procesos moleculares, facilitando una remodelación adecuada mediante la liberación de factores de crecimiento [17].Es impresionante cómo tanto el ejercicio de fuerza como el entrenamiento cardiovascular de resistencia han demostrado su eficacia para aumentar la síntesis de proteínas en el tejido conjuntivo muscular en seres humanos [8,9,18-22]. Específicamente, las fases excéntricas del entrenamiento se destacan por tener un impacto más contundente en la síntesis de proteínas del tejido conjuntivo intramuscular que las fases concéntricas, resaltando así el poderoso efecto estimulante que tienen al incrementar la tensión dentro del tejido muscular [23-25].
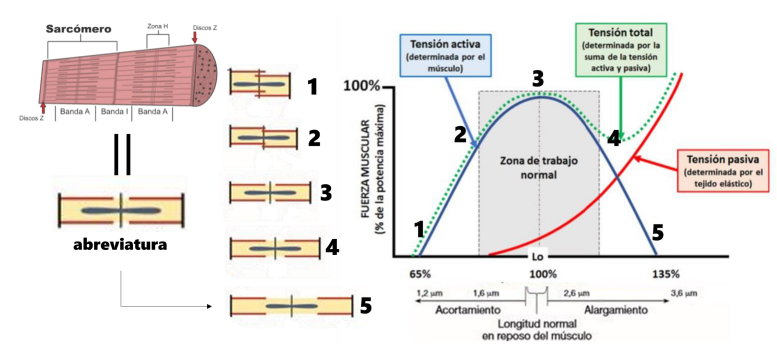
Durante las fases excéntricas, se genera una mayor tensión muscular y, por ende, una fuerza superior en comparación con las acciones concéntricas (+40%) e isométricas (+13-20%) al mismo nivel de activación muscular (Figura 2) [23-25]. Esta diferencia de energía (trabajo mecánico) favorece las fases excéntricas, ya que los elementos elásticos suman tensión pasiva a la actividad contráctil activa. El resultado es una serie de adaptaciones críticas que permiten la transmisión de mayores fuerzas contráctiles del músculo al tendón, ligamento y hueso, potenciando así nuestra capacidad de rendimiento y protegiendo la integridad de nuestros tejidos.
Al comprender cómo la carga mecánica y las fases excéntricas pueden estimular la síntesis de colágeno, podemos optimizar nuestro entrenamiento para mantener la salud de nuestros tejidos conectivos y mejorar nuestro rendimiento físico a lo largo del tiempo. La incorporación de ejercicios que enfoquen estas estrategias en nuestras rutinas puede marcar la diferencia en nuestra capacidad para adaptarnos, prevenir lesiones y alcanzar nuevos niveles de bienestar físico. ¡Descubre cómo maximizar los beneficios de tu entrenamiento y proteger tu salud músculo-esquelética con estas herramientas fundamentales!
Figura 2. Estructura del sarcómero muscular, contribución de los elementos activos (actina, miosina, titina…) y de los elementos pasivos a la producción de fuerza en la relación longitud – tensión.
Tanto el ejercicio fuerza como el de resistencia cardiovascular hayan mostrado ser efectivos para aumentar la síntesis de proteínas del tejido conjuntivo muscular en seres humanos. Concretamente, las fases excéntricas aumentan de forma más contundente las tasas de síntesis de proteínas del tejido conjuntivo intramuscular que las fases concéntricas, lo que refleja el potente efecto estimulante del aumento de la tensión dentro del tejido muscular.
3. Proteína de colágeno para la remodelación de tejido conectivo.
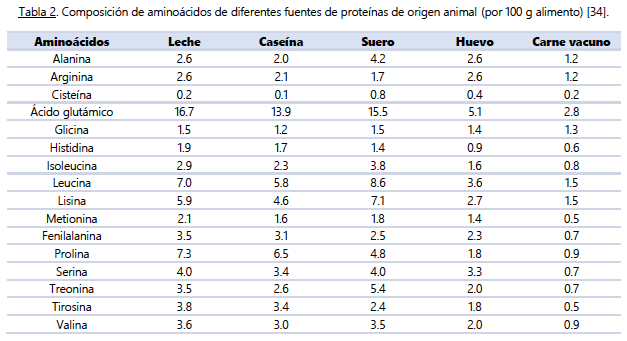
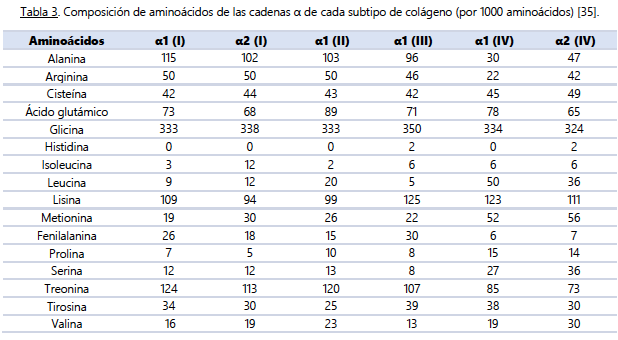
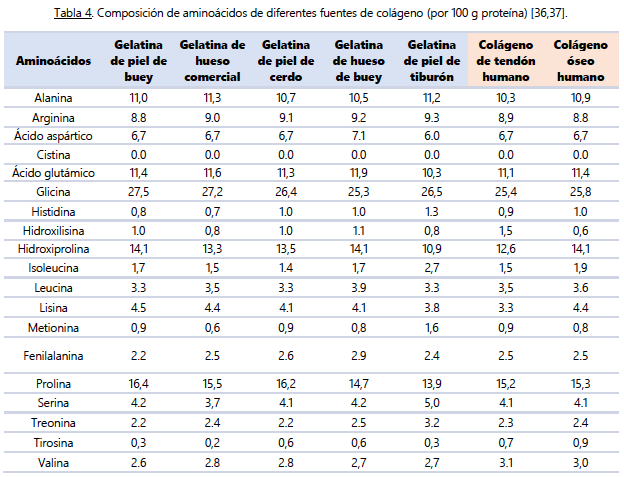
Un aspecto clave a tener en cuenta en relación con la proteína dietética y el ejercicio físico, especialmente el de fuerza, es la importancia de cumplir con ciertas cantidades diarias totales. Se ha demostrado que ingerir alrededor de 1.6 g / kg de peso corporal en un periodo normocalórico o de superávit, y 2.2 – 3.1 g / kg de peso corporal en un déficit calórico, permite obtener una respuesta anabólica mejorada a nivel músculoesquelético [26-30]. Sin embargo, a pesar de la ingesta de aminoácidos esenciales libres o fuentes de proteínas de alta calidad y de rápida digestión, como el suero o la caseína, se ha observado que esto no aumenta significativamente las tasas de síntesis de proteínas del tejido conjuntivo muscular en individuos jóvenes (18-35 años) o mayores (> 65 años) [8,22,31-33].La principal razón detrás de estos resultados radica en las diferencias entre los perfiles de aminoácidos de las proteínas de alta calidad (bajas en glicina y prolina) (ver Tabla 2) y el perfil de aminoácidos del tejido conjuntivo muscular (alto en prolina y glicina) (ver Tabla 3). Al no proporcionarse suficientes precursores de aminoácidos, el aumento en la síntesis de proteínas del tejido conectivo se ve afectado. Por tanto, es crucial considerar otras fuentes de proteínas derivadas del colágeno, como la gelatina y los péptidos de colágeno, que contienen mayores cantidades de prolina y glicina (ver Tabla 4). Estas fuentes pueden tener una mayor capacidad para estimular un incremento sustancial en las tasas de síntesis de proteínas del tejido conectivo y, por ende, promover la remodelación y salud de nuestros tejidos conectivos.
Las proteínas de alta calidad (suero, caseína, huevo) no muestran incremento de la síntesis proteica en el tejido conectivo debido a las diferencias entre sus perfiles de aminoácidos (bajos en glicina y prolina) y el perfil de aminoácidos del tejido conjuntivo muscular (alto en prolina y glicina). Otras fuentes de proteínas derivadas de colágeno, pueden tener mayor capacidad de estimular tasas de síntesis de proteínas del tejido conectivo y promover la remodelación del tejido conectivo.
3.1. Eficacia de diferentes tipos de proteína de colágeno
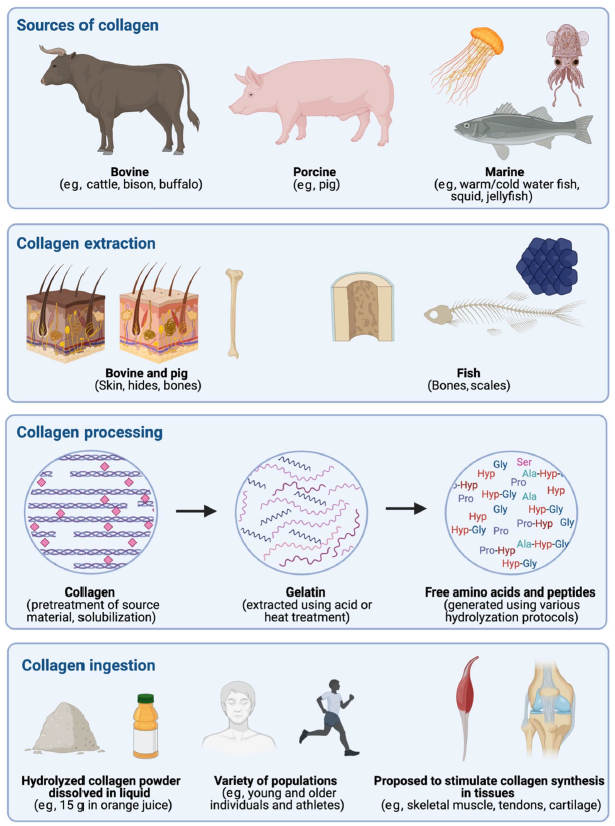
Aunque las proteínas dietéticas derivadas del colágeno han demostrado ser prometedoras en la remodelación del tejido conectivo, es esencial comprender la eficacia de los diferentes tipos de proteína de colágeno disponibles en el mercado. Aunque aún falta un conocimiento completo sobre las propiedades de digestión y absorción de estas proteínas y su impacto biológico en los tejidos humanos, ciertas revisiones nos proporcionan información valiosa para tomar decisiones informadas al elegir nuestras fuentes de consumo [38,39].En la Figura 3, podemos observar una representación gráfica del proceso de extracción de colágeno y su procesamiento industrial. Estas proteínas se extraen principalmente de la piel porcina (45%), la piel bovina (30%) y los huesos de ambos animales (23%). Aunque con menor frecuencia, también se utilizan subproductos de pollo (huesos) y pescado (escamas y huesos) como fuentes de proteína de colágeno [40-42].
Es relevante destacar que el colágeno derivado de fuentes de pescado suele tener menores contenidos de prolina e hidroxiprolina en comparación con el colágeno de fuentes porcinas o bovinas. Sin embargo, los peces de aguas cálidas tienden a tener los contenidos más altos de prolina e hidroxiprolina entre las diferentes especies [40-42].
El proceso de extracción de colágeno varía según la matriz de la fuente. Por ejemplo, el hueso contiene un alto contenido de minerales, mientras que la piel porcina contiene una alta cantidad de grasa. Sin embargo, en general, la extracción de colágeno implica diversas etapas, como recortar y limpiar el material de origen, pretratamiento para eliminar minerales y grasas, extracción, filtración, concentración, esterilización y secado.
Una forma popular de colágeno es el colágeno hidrolizado, que ha sido sometido a hidrólisis enzimática para reducir sus propiedades gelificantes. Esto permite que se mezcle fácilmente con agua y sea más fácil de ingerir. Además, se han desarrollado formulaciones específicas de péptidos de colágeno para optimizar la cantidad de dipéptidos y tripéptidos de hidroxiprolina con diferentes pesos moleculares, brindando mayor biodisponibilidad y funciones biológicas específicas para los tejidos diana [43-47]. Cabe destacar que no parece haber diferencias significativas en la biodisponibilidad de los aminoácidos clave al consumir diferentes formas de colágeno [42,43].
El colágeno en forma de gelatina es otra opción más accesible, disponible en supermercados e incluso con la posibilidad de ser fabricado artesanalmente en casa. Para deportistas de élite que se rigen por las reglas de la Agencia Mundial Antidopaje, este alimento debería priorizarse en lugar de acudir a suplementos dietéticos que pudieran llegar a estar contaminados, además de resultar más económico.
Algunas fórmulas de colágeno también incluyen ácido ascórbico (vitamina C), debido a su papel como cofactor en la síntesis de colágeno, potenciando así los beneficios de esta proteína en nuestro organismo.
Figura 3. Representación gráfica de las fuentes industriales de colágeno dietético, los procedimientos de extracción utilizados para producir colágeno hidrolizado y las propuestas de ingesta en humanos [39].
4. Evidencia actual para su uso en el deporte y como soporte articular.
Aunque la investigación in vivo sigue siendo limitada, se ha sugerido que la suplementación con colágeno puede ayudar en la prevención y/o el tratamiento de lesiones de tejido muscular, cartilaginoso, conjuntivo y óseo y/o trastornos degenerativos [38]. Concretamente, se han observado tiempos más reducidos en la vuelta a la competición tras una lesión, reducción del dolor articular subjetivo como variable importante en la calidad de vida, además de una disminución de la inflamación y el daño muscular después de ejercicio intenso.En resumen, la suplementación con colágeno y/o la mayor disponibilidad de los aminoácidos que predominan en el colágeno pueden ser beneficiosos tanto para la prevención como para el tratamiento de lesiones y trastornos degenerativos del tejido conjuntivo y óseo. Tanto es así que el Instituto Australiano del Deporte lo clasifica con un nivel de evidencia B en una escala de A – D, como “suplemento emergente con potencial de eficacia, aunque merece más investigación“ [38]. Eso sí, se advierte de que el uso de colágeno como suplemento deportivo debe utilizarse como parte de un protocolo de prevención o tratamiento de lesiones, no como un reemplazo de otros procesos tradicionales bien establecidos (ej. entrenamiento, nutrición general).
La suplementación con colágeno y/o la mayor disponibilidad de los aminoácidos que predominan en el colágeno (prolina, glicina, hidroxiprolina) pueden ser beneficiosos tanto para la prevención como para el tratamiento de lesiones y trastornos degenerativos del tejido conjuntivo y óseo. Tanto es así que el Instituto Australiano del Deporte lo clasifica con un nivel de evidencia B en una escala de A – D, como “suplemento emergente con potencial de eficacia, aunque merece más investigación”.
4.1.Protocolo de uso.
En cuanto a las dosis óptimas, parece ser que un mínimo de 20 gramos por toma resulta óptimo para una mayor disponibilidad de los aminoácidos principalmente presentes en el colágeno. De cualquier forma, es posible que, de forma similar a otros tipos de proteínas, exista una relación dosis-respuesta relativa al peso corporal, sin embargo, esto requiere más investigación.Consumido diariamente:
Junto con ejercicio específico para ayudar a controlar el dolor en afecciones inflamatorias como la tendinitis.
Para ayudar a reducir el dolor articular relacionado con la actividad.
Para el tratamiento / prevención de enfermedades degenerativas, como la osteoartritis.
Ayudar a fortalecer los huesos con el fin de reducir el riesgo de fracturas.
Consumido 40 – 60 minutos antes del ejercicio para:
Ayudar a apoyar el recambio de colágeno en el tejido conectivo al proporcionar una mayor disponibilidad de aminoácidos durante los períodos de mayor recambio, particularmente cuando el
cuerpo no puede satisfacer la demanda y / o cuando la ingesta total de proteínas es subóptima, como durante un alto estímulo de entrenamiento.
Ayudar a mantener la integridad del tejido en personas con lesiones previas del tejido conectivo.
Apoyar la reparación de varios tejidos, incluidos los huesos, la piel y los ligamentos / tendones durante la rehabilitación.
Consumido inmediatamente después del ejercicio (≤ 2 horas) para:
Apoyar la reparación / recuperación del tejido muscular y potencialmente reduce el dolor muscular de aparición tardía.
5. Bibliografía y referencias.
1. Gelse, K., Pöschl, E., & Aigner, T. (2003). Collagens—structure, function, and biosynthesis. Advanced drug delivery reviews, 55(12), 1531-1546.2. Gillies, A. R., & Lieber, R. L. (2011). Structure and function of the skeletal muscle extracellular matrix. Muscle & nerve, 44(3), 318-331.
3. Gartner, L. P. (2020). Textbook of Histology E-Book. Elsevier Health Sciences.
4. Bishop, J. E., & Laurent, G. J. (1995). Collagen turnover and its regulation in the normal and hypertrophying heart. European heart journal, 16(suppl_C), 38-44.
5. Babraj, J. A., Cuthbertson, D. J., Smith, K., Langberg, H., Miller, B., Krogsgaard, M. R., … & Rennie, M. J. (2005). Collagen synthesis in human musculoskeletal tissues and skin. American Journal of Physiology-Endocrinology and Metabolism, 289(5), E864-E869.
6. Moore, D. R., Phillips, S. M., Babraj, J. A., Smith, K., & Rennie, M. J. (2005). Myofibrillar and collagen protein synthesis in human skeletal muscle in young men after maximal shortening and lengthening contractions. American Journal of Physiology-Endocrinology and Metabolism, 288(6), E1153-E1159.
7. Miller, B. F., Olesen, J. L., Hansen, M., Døssing, S., Crameri, R. M., Welling, R. J., … & Rennie, M. J. (2005). Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. The Journal of physiology, 567(3), 1021-1033.
8. Trommelen, J., Holwerda, A. M., Senden, J. M., Goessens, J. P., Van Kranenburg, J., Gijsen, A. P., … & Van Loon, L. J. (2020). Casein ingestion does not increase muscle connective tissue protein synthesis rates. Medicine and science in sports and exercise, 52(9), 1983.
9. Holwerda, A. M., Trommelen, J., Kouw, I. W., Senden, J. M., Goessens, J. P., van Kranenburg, J., … & van Loon, L. J. (2021). Exercise Plus Presleep Protein Ingestion Increases Overnight Muscle Connective Tissue Protein Synthesis Rates in Healthy Older Men. International Journal of Sport Nutrition and Exercise Metabolism, 31(3), 217-226.
10. Stantzou, A., Relizani, K., Morales‐Gonzalez, S., Gallen, C., Grassin, A., Ferry, A., … & Amthor, H. (2021). Extracellular matrix remodelling is associated with muscle force increase in overloaded mouse plantaris muscle. Neuropathology and Applied Neurobiology, 47(2), 218-235.
11. De Boer, M. D., Selby, A., Atherton, P., Smith, K., Seynnes, O. R., Maganaris, C. N., … & Rennie, M. J. (2007). The temporal responses of protein synthesis, gene expression and cell signalling in human quadriceps muscle and patellar tendon to disuse. The Journal of physiology, 585(1), 241-251.
12. Dideriksen, K., Boesen, A. P., Reitelseder, S., Couppé, C., Svensson, R., Schjerling, P., … & Kjaer, M. (2017). Tendon collagen synthesis declines with immobilization in elderly humans: no effect of anti-inflammatory medication. Journal of applied physiology, 122(2), 273-282.
13. Haus, J. M., Carrithers, J. A., Trappe, S. W., & Trappe, T. A. (2007). Collagen, cross-linking, and advanced glycation end products in aging human skeletal muscle. Journal of applied physiology, 103(6), 2068-2076.
14. Hughes, D. C., Wallace, M. A., & Baar, K. (2015). Effects of aging, exercise, and disease on force transfer in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism, 309(1), E1-E10.
15. Azizi, E., Deslauriers, A. R., Holt, N. C., & Eaton, C. E. (2017). Resistance to radial expansion limits muscle strain and work. Biomechanics and modeling in mechanobiology, 16(5), 1633-1643.
16. Kragstrup, T. W., Kjaer, M., & Mackey, A. L. (2011). Structural, biochemical, cellular, and functional changes in skeletal muscle extracellular matrix with aging. Scandinavian journal of medicine & science in sports, 21(6), 749-757.
17. Chiquet, M., Gelman, L., Lutz, R., & Maier, S. (2009). From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1793(5), 911-920.
18. Miller, B. F., Hansen, M., Olesen, J. L., Flyvbjerg, A., Schwarz, P., Babraj, J. A., … & Kjaer, M. (2006). No effect of menstrual cycle on myofibrillar and connective tissue protein synthesis in contracting skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism, 290(1), E163-E168.
19. Hansen, M., Miller, B. F., Holm, L., Doessing, S., Petersen, S. G., Skovgaard, D., … & Langberg, H. (2009). Effect of administration of oral contraceptives in vivo on collagen synthesis in tendon and muscle connective tissue in young women. Journal of Applied Physiology, 106(4), 1435-1443.
20. Holm, L., Van Hall, G., Rose, A. J., Miller, B. F., Doessing, S., Richter, E. A., & Kjaer, M. (2010). Contraction intensity and feeding affect collagen and myofibrillar protein synthesis rates differently in human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism, 298(2), E257-E269.
21. Burd, N. A., Mitchell, C. J., Churchward-Venne, T. A., & Phillips, S. M. (2012). Bigger weights may not beget bigger muscles: evidence from acute muscle protein synthetic responses after resistance exercise. Applied physiology, nutrition, and metabolism, 37(3), 551-554.
22. Mikkelsen, U. R., Dideriksen, K., Andersen, M. B., Boesen, A., Malmgaard-Clausen, N. M., Sørensen, I. J., … & Holm, L. (2015). Preserved skeletal muscle protein anabolic response to acute exercise and protein intake in well-treated rheumatoid arthritis patients. Arthritis research & therapy, 17(1), 1-19.
23. Seger, J. Y., Arvidsson, B., Thorstensson, A., & Seger, J. Y. (1998). Specific effects of eccentric and concentric training on muscle strength and morphology in humans. European journal of applied physiology and occupational physiology, 79(1), 49-57.
24. Parr, J. J., Yarrow, J. F., Garbo, C. M., & Borsa, P. A. (2009). Symptomatic and functional responses to concentric-eccentric isokinetic versus eccentric-only isotonic exercise. Journal of athletic training, 44(5), 462-468.
25. Roig, M., OBrien, K., Kirk, G., Murray, R., McKinnon, P., Shadgan, B., & Reid, W. D. (2009). The effects of eccentric versus concentric resistance training on muscle strength and mass in healthy adults: a systematic review with meta-analysis. British journal of sports medicine, 43(8), 556-568.
26. Tipton, K. D., & Phillips, S. M. (2013). Dietary protein for muscle hypertrophy. Limits of Human Endurance, 76, 73-84.
27. Morton, R. W., McGlory, C., & Phillips, S. M. (2015). Nutritional interventions to augment resistance training-induced skeletal muscle hypertrophy. Frontiers in physiology, 6, 245.
28. Aragon, A. A., Schoenfeld, B. J., Wildman, R., Kleiner, S., VanDusseldorp, T., Taylor, L., … & Antonio, J. (2017). International society of sports nutrition position stand: diets and body composition. Journal of the International Society of Sports Nutrition, 14(1), 1-19.
29. Kerksick, C. M., Wilborn, C. D., Roberts, M. D., Smith-Ryan, A., Kleiner, S. M., Jäger, R., … & Kreider, R. B. (2018). ISSN exercise & sports nutrition review update: research & recommendations. Journal of the International Society of Sports Nutrition, 15(1), 1-57.
30. Morton, R. W., Murphy, K. T., McKellar, S. R., Schoenfeld, B. J., Henselmans, M., Helms, E., … & Phillips, S. M. (2018). A systematic review, meta-analysis and meta-regression of the effect of protein supplementation on resistance training-induced gains in muscle mass and strength in healthy adults. British journal of sports medicine, 52(6), 376-384.
31. Dideriksen, K., Reitelseder, S., Malmgaard-Clausen, N. M., Bechshoeft, R., Petersen, R. K., Mikkelsen, U. R., & Holm, L. (2016). No effect of anti-inflammatory medication on postprandial and postexercise muscle protein synthesis in elderly men with slightly elevated systemic inflammation. Experimental gerontology, 83, 120-129.
32. Dideriksen, K. J., Reitelseder, S., Petersen, S. G., Hjort, M., Helmark, I. C., Kjaer, M., & Holm, L. (2011). Stimulation of muscle protein synthesis by whey and caseinate ingestion after resistance exercise in elderly individuals. Scandinavian journal of medicine & science in sports, 21(6), e372-e383.
33. Holm, L., Rahbek, S. K., Farup, J., Vendelbo, M. H., & Vissing, K. (2017). Contraction mode and whey protein intake affect the synthesis rate of intramuscular connective tissue. Muscle & nerve, 55(1), 128-130.
34. Gorissen, S. H., Crombag, J. J., Senden, J. M., Waterval, W. H., Bierau, J., Verdijk, L. B., & van Loon, L. J. (2018). Protein content and amino acid composition of commercially available plant-based protein isolates. Amino acids, 50(12), 1685-1695.
35. Cunningham, L.W., Frederiksen, D.W. (1982). Structural and Contractile Proteins. New York: Academic Press.
36. Eastoe, J. E. (1955). The amino acid composition of mammalian collagen and gelatin. Biochemical Journal, 61(4), 589-600.
37. Eastoe, J. E. (1957). The amino acid composition of fish collagen and gelatin. Biochemical Journal, 65(2), 363-368.
38. Australian Institute of Sport (2021). Position Statement. Supplements and sports foods in high performance sport. Recuperado de https://cutt.ly/QmO8RbU a 4 de octubre de 2021.
39. Holwerda, A.M, van Loon, L.J. (2021), The impact of collagen protein ingestion on musculoskeletal connective tissue remodeling: a narrative review, Nutrition Reviews, nuab083.
40. Shahidi, F. (Ed.). (2006). Maximising the value of marine by-products. Woodhead Publishing.
41. Bae, I., Osatomi, K., Yoshida, A., Osako, K., Yamaguchi, A., & Hara, K. (2008). Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes. Food chemistry, 108(1), 49-54.
42. Gómez-Guillén, M. C., Giménez, B., López-Caballero, M. A., & Montero, M. P. (2011). Functional and bioactive properties of collagen and gelatin from alternative sources: A review. Food hydrocolloids, 25(8), 1813-1827.
43. Schunck, M., & Oesser, S. (2013). Specific collagen peptides benefit the biosynthesis of matrix molecules of tendons and ligaments. Journal of the International Society of Sports Nutrition, 10(1), 1-2.
44. Oesser, S., Schulze, C. H., Zdzieblik, D., & König, D. (2016). Efficacy of specific bioactive collagen peptides in the treatment of joint pain. Osteoarthritis and Cartilage, 24, S189.
45. Edgar, S., Hopley, B., Genovese, L., Sibilla, S., Laight, D., & Shute, J. (2018). Effects of collagen-derived bioactive peptides and natural antioxidant compounds on proliferation and matrix protein synthesis by cultured normal human dermal fibroblasts. Scientific reports, 8(1), 1-13.
46. Oertzen-Hagemann, V., Kirmse, M., Eggers, B., Pfeiffer, K., Marcus, K., de Marées, M., & Platen, P. (2019). Effects of 12 weeks of hypertrophy resistance exercise training combined with collagen peptide supplementation on the skeletal muscle proteome in recreationally active men. Nutrients, 11(5), 1072.
47. León-López, A., Morales-Peñaloza, A., Martínez-Juárez, V. M., Vargas-Torres, A., Zeugolis, D. I., & Aguirre-Álvarez, G. (2019). Hydrolyzed collagen—sources and applications. Molecules, 24(22), 4031.