LAS ENFERMEDADES TRANSMITIDAS POR LOS ALIMENTOS (Parte 19)
ESCOMBROTOXINA
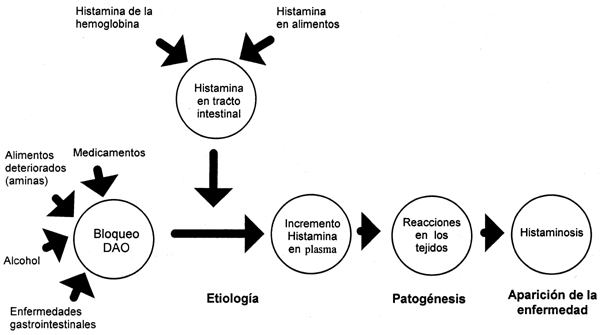
El envenenamiento escromboide o por escombrotoxina, es causado por la ingestión de alimentos que contienen altos niveles de histamina y posiblemente otras aminas y compuestos vasoactivos. La histamina y las otras aminas se forman por el crecimiento de ciertas bacterias y la consecuente acción de sus enzimas descarboxilasas en la histidina y en otros aminoácidos en los alimentos, ya sea durante su producción como es el caso del queso suizo o por que se dé un deterioro de los alimentos tal como productos de pescado, particularmente de atún. Sin embargo, cualquier alimento que contenga los aminoácidos adecuados y que sea sujeto a cierta contaminación y crecimiento bacteriano, puede dar lugar a un envenenamiento escromboide cuando se consuma. La intoxicación por escombroides generalmente ocurre en peces llamados azules o de carne oscura como el atún, la caballa y el bonito. Dado que este tóxico se desarrolla después de que el pez es capturado y muere, el lugar donde haya sido pescado realmente no importa. El principal factor es por cuánto tiempo el pescado permanece al aire libre sin ser refrigerado ni congelado. Los síntomas iniciales pueden incluir sensaciones de hormigueo o picazón en la boca, erupciones en la parte superior del cuerpo y un descenso en la presión sanguínea.
Frecuentemente, también produce dolor de cabeza y picor de la piel. Los síntomas pueden progresar hasta náuseas, vómitos y diarrea y puede requerir hospitalización, particularmente en el caso de pacientes de edad avanzada o enfermos. Los síntomas de la intoxicación comienzan rápidamente, en un rango desde inmediatamente hasta unos 30 minutos. La duración de la enfermedad es normalmente de 3 horas, pero puede durar varios días. El diagnóstico de la enfermedad normalmente se basa en los síntomas del paciente, el tiempo de comienzo y el efecto del tratamiento con medicación antihistamínica. El alimento sospechoso debe ser analizado a las pocas horas en busca de altos niveles de histamina para confirmar el diagnóstico. Entre los productos piscícolas que están implicados en el envenenamiento escómbrico se incluyen los túnidos (por ejemplo el bonito y el atún claro), el delfín dorado, anjova, sardinas, caballa, serviola y abalón. Muchos otros productos han causado también los efectos tóxicos. El queso más extendido que más intoxicaciones causa es el queso suizo. Las toxinas se forman en un alimento cuando ciertas bacterias están presentes y el tiempo y la temperatura permiten su crecimiento. La distribución de las toxinas dentro de un filete de pescado individual o entre latas en un lote completo puede ser irregular, por lo tanto unas secciones del producto causarían la enfermedad y otras no. Ni el cocinado, ni el enlatado, ni el congelado reducen el efecto tóxico.
El examen sensorial del consumidor no puede asegurar la ausencia o presencia de la toxina. Las pruebas químicas son la única manera fiable para la evaluación de un producto. Por lo tanto todos los pescados que no estén frescos, o que estén mal conservados pueden contener histamina o productos relacionados. Afortunadamente, la producción de histamina, pero no siempre, se correlaciona con la producción de amoniaco, lo que resulta en un deterioro visible o en mal olor. Todos los humanos son susceptibles al envenenamiento escromboide; sin embargo, los síntomas pueden ser severos para las personas mayores y para aquellos que estén tomando medicación del tipo de isoniazida. Dada la red mundial de crianza, procesado y distribución de productos piscícolas, el impacto del problema no está limitado a áreas geográficas específicas o a un patrón de consumo. La histamina es un compuesto de presencia normal en el organismo que se forma a partir de la descarboxilación del aminoácido L-histidina. Es sintetizada y almacenada en células especializadas, principalmente mastocitos (células sub-epiteliales de los tejidos) y basófilos de la sangre, que regulan su liberación de acuerdo a la necesidad. Debido al comportamiento de su anillo imidazólico que se encuentra ionizado a pH fisiológico, la histamina resulta implicada en actividades biológicas normales y subnormales siendo un mensajero químico que media un amplio rango de respuestas celulares que incluyen reacciones alérgicas e inflamatorias, vasodilatación, secreción gástrica y neurotransmisión.
Puede existir en una variedad de formas a diversos pH, así por ejemplo a pH de 7,4 se le encuentra en estado ionizado con un sitio protonado en su cadena. Como consecuencia de un pequeño cambio de pH, de seis a siete, la histamina puede cambiar de ser un aceptor de cargas, a ser un donador de cargas; por eso que, no debe sorprendernos que debido a estas propiedades electrónicas, la histamina presente una actividad fisiológica muy importante. El nivel de histamina en la sangre normalmente se reporta entre los 25 y 130 µg/Lt, este rango puede alterarse en caso de estimulación. Cuando el nivel de histamina circulante es elevado, se generan desequilibrios que alteran el estado normal del individuo. La liberación de histamina de las células es la primera respuesta frente a algunos estímulos; entre estos se incluyen la presencia de toxinas bacterianas, picaduras de insectos, destrucción celular por cambios de temperaturas extremas, traumas, alergias, anafilaxis y reacciones de hipersensibilidad.
El mecanismo de acción de la histamina sobre los tejidos describe su efecto sobre la unión de dos tipos de receptores designados como H1 y H2 que están localizados en la superficie de las células blanco, teniendo distintos tipos de acción en diferentes tejidos de acuerdo al receptor al que estén unidos. Así, cuando la histamina está actuando sobre el receptor H1 solamente, el músculo liso bronquial e intestinal se contraen, las terminaciones nerviosas causan dolor y picazón y se incrementa la producción de moco bronquial y nasal. Cuando actúa solo sobre el receptor H2, en el estómago se estimula la secreción del ácido clorhídrico. Cuando está unido a ambos receptores, el sistema cardiovascular sufre vasodilatación periférica (baja presión arterial), mientras aumenta la permeabilidad de los otros capilares con pérdida de fluidos (edemas, zonas enrojecidas).
La histamina exógena, es decir, histamina que no es sintetizada por el organismo, sino que su presencia está ligada al consumo de alimentos usados como vehículos para su ingreso al organismo, genera una enfermedad conocida comúnmente como "intoxicación" con un período de incubación típicamente corto, subsistiendo los síntomas por unas pocas horas en la mayoría de los casos. La intoxicación por histamina presenta síntomas de naturaleza neurológico-cutánea, gastrointestinal y hemodinámica, observándose luego del consumo del alimento: edema, inflamación, dolor de cabeza, palpitaciones, enrojecimiento, hormigueo, urticaria, quemazón, comezón, sarpullidos, nausea, vómito, diarrea, calambres e hipotensión. La severidad de los síntomas de la intoxicación dependerá entonces de la cantidad de histamina consumida, de la presencia de otros reaccionantes, sinérgicos y antagónicos, así como de la sensibilidad del paciente a la ingestión de éstos compuestos. El diagnóstico de la enfermedad debe ser estudiado con mucho detenimiento, pues puede ser confundida con una "alergia" por consumo de alimentos.
Así, la intoxicación debe ser distinguida por presentar:
· Carencia de historias previas de reacciones alérgicas (antecedentes) por consumo de algún alimento en particular
· Presencia de intoxicación en más de una persona
· Detección de altos niveles de histamina en el alimento consumido
Algunos alimentos como pescados y mariscos, quesos (especialmente los de prolongada maduración), jamones y otros de tipo fermentado, contienen algunas veces, elevados niveles de histamina y han sido involucrados en apariciones de intoxicación. Normalmente pequeñas cantidades de histamina presentes en la dieta casi no tienen efectos dañinos, pues éstas son removidas por la flora presente en el tracto digestivo impidiendo su absorción, sin embargo, en algunos casos, la histamina presente en altas concentraciones, atraviesa la barrera gastrointestinal, en cuyo caso puede ocurrir la intoxicación; la intensidad de ésta, dependerá de las concentraciones circulantes de histamina. Lamentablemente no existe una buena relación estadística sobre la incidencia / prevalencia del envenenamiento por histamina (escombrotoxina), debido principalmente a la falta de programas de salud y a las características propias de la enfermedad que es de curso muy corto; siendo la terapia antihistamínica el tratamiento óptimo para este tipo de intoxicación. El conocimiento actual sobre los mecanismos de la escombrotoxicosis no es a la fecha definitivo. Se considera necesaria la revisión de los estudios científicos referentes, para establecer o modificar los límites de acción legal en el nivel de histamina a fin de establecer normas sanitarias.
Mientras no se determine la identidad de las toxinas involucradas en el envenenamiento, los niveles y la acción de los potenciadores, es imposible definir una dosis tóxica para la histamina presente en los pescados. Administrando hasta 4 mg de histamina pura / kg de peso corporal a voluntarios controlados no se lograron tener efectos de toxicidad, mientras que con sólo administrar filetes de caballa con histamina, a estos mismos voluntarios (0,3 mg de histamina / kg de peso corporal), se produjeron síntomas de envenenamiento. En la mayoría de casos, los niveles de histamina encontrados en pescados asociados a la enfermedad conocida como escombrotoxicosis, están por encima de los 200 ppm y más comúnmente, por encima de 500 ppm . Sin embargo, se sospecha que otros productos químicos también juegan un rol importante en la aparición de la enfermedad, como son otras aminas biogénicas, toxinas, inhibidores enzimáticos, etc. que se generan por acción bacteriana y no se destruyen durante los procesos de congelación, cocción, curado o conservería. Si bien se ha encontrado una relación directa entre la intoxicación y el consumo de pescado que contiene niveles elevados de histamina; aún no se ha determinado al agente causal en sí de la escombrotoxicosis, pues no se ha logrado reproducir la enfermedad al administrar histamina pura a voluntarios que si enfermaron al consumir dosis semejantes en pescado.
La falta de toxicidad de la histamina pura, dada en forma oral aún en niveles elevados, y, la toxicidad generada por la ingestión de pequeñas dosis de histamina en pescado, lleva a sospechar de la presencia de algunos "potenciadores de toxicidad" en el pescado descompuesto. Entre los posibles potenciadores están la trimetilamina, el óxido de trimetilamina y otras aminas biogénicas tales como la putrescina, la cadaverina, anserina, espermina, espermidina y agmantina. Los estudios hechos con dichos "potenciadores" aún no han llegado a conclusiones determinantes. La existencia de inhibidores de la diamino oxidasa y de la histamina metil transferasa, también incrementarían la toxicidad, debido a que la remoción de las aminas biogénicas a nivel del tracto digestivo se vería perjudicada, ingresando las aminas en forma activa al torrente sanguíneo. Estudios con voluntarios médicamente controlados, han demostrado que, las aminas encontradas comúnmente en la caballa no son agentes responsables de la escombrotoxicosis, no presentando acción individual, aditiva o sinergista ni otro tipo de respuestas a dosis típicas. Estos mismos estudios sugieren que la liberación de la histamina endógena (histamina liberada por los mastocitos), es la que juega un rol importante en la intoxicación. Por otro lado, hay evidencias que señalan que algunos peces podrían acumular toxinas marinas provenientes de sus alimentos (plancton, larvas de crustáceos, huevos de peces, juveniles, etc.), y generar intoxicaciones de manera similar a la escombrotoxina, aunque aún faltan mayores estudios al respecto. Todas éstas observaciones conducen a suponer que la escombrotoxina es el agente degranulante de los mastocitos, y, que los síntomas del envenenamiento son debido a la liberación de la histamina endógena y otras sustancias biológicamente activas, liberadas por nuestro organismo.
Podemos pensar que algunas moléculas de origen externo (histamina, otras aminas biogénicas, inhibidores enzimáticos y toxinas), en conjunto, presenten una acción aditiva y/o potenciadora de la intoxicación, todo dependería de la concentración de cada una de ellas y de su efecto sobre las características propias del hospedero; no debiendo involucrar solo a una molécula como la responsable de la escombrotoxicosis. Si bien no se puede hablar directamente de la histamina como único agente responsable de la escombrotoxicosis, de lo que no hay duda es, de la relación directa entre la aparición de la intoxicación y de la presencia de niveles elevados de histamina en los pescados consumidos. La dosis tóxica mínima no ha sido aún establecida, debido a la variabilidad de los niveles de histamina en el pescado descompuesto, así como a la variabilidad de respuesta de los pacientes. La dosis tóxica a fines de la década de los 50 fue establecida en 60 mg/100 g, aunque con el correr de los años este dato ha sido cuestionado y corregido.
Estudios epidemiológicos, han llegado a las siguientes conclusiones para la concentración de histamina en los pescados:
<5 mg/100g de Hm (< 50 ppm): Pescado normal, seguro para su consumo.
5 - 20 mg/100g de Hm (50 - 200 ppm): Pescado maltratado y posiblemente tóxico.
20-100 mg/100g de Hm (200 - 1000 ppm): Pescado no satisfactorio probablemente tóxico.
Cabe puntualizar que, si bien la norma europea solo contempla a los escómbridos y a los clupeidos, actualmente, algunos países como Nueva Zelandia, está considerando especies de riesgo a todas aquellas que contengan un alto contenido de histidina libre en el músculo; así también, el Arenque del Atlántico (clupeido), inicialmente considerado entre el grupo de especies afectadas por la formación de histamina, ha sido retirada de la lista de Guía de Peligros que maneja FDA de Estados Unidos. Reglamentaciones dadas por los Estados Unidos, sobre niveles de histamina en pescados están contemplados en la guía de la FDA (Food and Drugs Administration). La Guía de Control y Peligro de Pescados y Productos Pesqueros de la FDA , establece que los niveles de histamina no deberán exceder los 5 mg/100 g (50 ppm) para pescado fresco y de los 20 mg/100 g (200 ppm) para pescado enlatado.
En la calificación del producto debe tenerse en cuenta tanto los factores intrínsecos (proteína, histamina, bases volátiles, etc.) como su aporte en la masa total del alimento a consumirse. Así por ejemplo, la harina de pescado, que es usada como ingrediente en la preparación de alimentos balanceados y ésta solo aporta alrededor de un 10% del total del producto, entonces, una harina de 250 ppm en un alimento balanceado aportará solo un décimo (1/10) de su masa, el valor final de histamina en el alimento será de 25 ppm (valor no peligroso). Algunas especies de pescados contienen naturalmente grandes cantidades de histidina libre en sus tejidos; además que la proteólisis, ya sea autolítica o bacteriana, puede jugar a su vez un rol importante en la liberación de más histidina que puede servir como sustrato a la histidina descarboxilasa bacteriana. La formación de histamina es resultado del mal manipuleo y una mala preservación del pescado; generalmente pescados almacenados en lugares con poca higiene y a temperaturas por encima de las de refrigeración en tiempos prolongados, son susceptibles a formar grandes cantidades de histamina, siempre que presenten histidina libre en sus músculos.
Algunas malas prácticas de captura, generalmente cuando al pescado se le ha permitido luchar sobre la línea por un período relativamente prolongado de tiempo, pueden causar un incremento de la temperatura interna, favoreciendo el crecimiento bacteriano, formándose histamina antes de que el pescado esté sobre la embarcación. Existen medios microbiológicos enriquecidos con extractos de músculo de pescado que permiten aislar y cuantificar las bacterias formadoras de histamina. Diversas referencias indican que sólo un porcentaje menor de microflora contaminante, es responsable de la formación de histamina, lo cual nos llevaría a concluir que, no siempre los niveles de histamina indican el mal estado del producto, pues el pescado también puede ser contaminado con bacterias que no producen histamina, formando otros productos de descomposición. Se han reportado ocurrencias de formación de histamina aún a temperaturas moderadas (entre los 4 y los 10°C) siendo todavía tema de controversia. Las bacterias formadoras de histamina son capaces de crecer y producirla en un amplio rango de temperaturas, sin embargo, su acción es más rápida a temperaturas que fluctúan alrededor de 21ºC o más. Las bacterias asociadas a la formación de histamina están comúnmente sobre las agallas y en los intestinos del pez vivo sin originar daño; una vez muerto el pez, sus mecanismos de defensa no inhiben el crecimiento bacteriano, aumentando el número de bacterias que aprovechan la histidina libre presente en al medio. Enterobacterias (especialmente especies de Proteus y Klebsiella) forman histamina como producto secundario de su metabolismo por acción de su enzima histidina descarboxilasa. Al investigar la microflora responsable de la descomposición, es importante identificar a las bacterias formadoras de histamina, a fin de determinar el porcentaje de la población bacteriana total que ellas representan.
Las bacterias intestinales formadoras de histamina más abundantes en el pescado son: Morganella morganii, Klebsiella pneumoniae, Proteus vulgaris y Hafnia alvei, éstos han sido aislados de pescados implicados en la mayoría de envenenamientos. Ciertas bacterias no intestinales del pescado son también capaces de producir histamina en condiciones de anaerobiosis (Clostridium perfringens); a temperaturas de refrigeración (la psicrófila Photobacterium spp); a temperaturas de refrigeración y salinidad elevada, perteneciendo a este último un grupo de bacterias psicrofílicas y halofílicas denominadas "bacterias grupo-N". La mayor parte de estudios toman como consenso que las bacterias formadoras de histamina son principalmente organismos mesófilos (adaptados a temperaturas entre los 20 y 37°C), sin embargo, se ha demostrado que Klebsiella pneumoniae es capaz de producir histamina a 7ºC después de prolongados períodos de almacenamiento; y las aún no identificadas "bacterias grupo-N", que parecen formar parte de la microflora normal de la superficie del pescado, son capaces de producir histamina a temperaturas de hasta 2,5ºC. Se ha observado también la aparición de histamina en filetes empacados al vacío y almacenados a temperaturas de refrigeración, así como en productos salados almacenados a 5ºC; el principal argumento para esta formación es que, una vez presente la enzima histidina descarboxilasa, ésta puede continuar la producción de histamina en el pescado, aún cuando la bacteria deje de ser activa (muerta o con metabolismo mínimo). La enzima puede continuar activa a temperaturas de refrigeración y es probablemente más estable en estado congelado que dentro de la célula bacteriana misma (mínima acción de proteasas), pudiendo reactivarse muy rápidamente durante el descongelamiento. Tanto la enzimas como las bacterias pueden ser inactivadas por cocción; sin embargo una vez que la histamina ya está formada no es posible eliminarla. Después de la cocción del pescado, la recontaminación con bacterias formadoras de histamina es poco probable (por la menor proporción de ellas en el ambiente), por esta razón el desarrollo de histamina es más frecuente en pescados crudos. Considerando que el efecto de la temperatura en la formación de histamina es determinante, el rápido enfriamiento del pescado después de muerto es la principal estrategia para prevenir la formación de histamina (escombrotoxina).
El almacenamiento a bajas temperaturas después de la captura, es la clave para el control en la acumulación de la histamina bacteriana en el pescado, aunque, es necesario aún investigar más a fondo la formación de histamina en el almacenaje a bajas temperaturas. La temperatura interna del pescado deberá ser llevada a 10ºC o menos durante las primeras 6 horas después de capturado el pez. Luego de éste enfriamiento inicial, es recomendable llevar a los pescados por debajo de los 4°C dentro de las 18 horas siguientes; éstas acciones previenen, el crecimiento bacteriano y acción de la histidina descarboxilasa. Una vez que la enzima esté formada el control del peligro es improbable. Se debe tener en cuenta también las variaciones estacionales de los aminoácidos libres en el músculo del pescado. Existe información que nos indica que la concentración de histamina libre en el músculo varía según las estaciones, llegando a concluir que existen épocas donde hay más susceptibilidad para formar mayor concentración de histamina. Estudios relacionados a la preservación del pescado, encontraron que, tanto el uso del ácido propiónico como del ácido acético, en cantidades adecuadas, retardan el crecimiento bacteriano; por tanto, el uso de éstos preservantes, puede conducir a una menor formación de histamina, otras aminas biógenas u otros productos provenientes del deterioro.
Actualmente se están estudiando otros inhibidores del crecimiento bacteriano de origen natural (bactericidas y/o bacteriostáticos) con la finalidad de disminuir la formación de productos de descomposición.
FITOHEMAGLUTININA
También se conoce como envenenamiento por habichuelas rojas, envenenamiento por judías Kintoki, y posiblemente por otros nombres, y es causada por una lectina o hemaglutinina. Las lectinas son sustancias químicas muy comunes en las plantas, y algunas de ellas hacen que la sangre se aglutine, por lo que reciben el nombre de hemaglutininas. Las fitohemaglutininas, el supuesto agente tóxico, se encuentra en muchas especies de judías, pero donde se encuentran en mayor concentración es en los frijoles rojos (Phaseolus vulgaris). La unidad de medida de las toxinas es la unidad de hemaglutinación (hau). Los frijoles rojos crudos contienen de 20.000 a 70.000 hau, mientras que cuando están completamente cocinados contienen de 200 a 400 hau. Las judías blancas, otra variedad de Phaseolus vulgaris, contienen acerca de un tercio de la cantidad de toxina contenida en la variedad roja; Las habas (Vicia faba) contienen de un 5 a un 10% de la cantidad contenida de las habichuelas rojas. Los casos (de los que se da noticia) son muy raros y están de manera mayoritaria limitados al Reino Unido. El tiempo que transcurre desde que se consumen las judías crudas o poco cocinadas hasta que aparecen los síntomas varía de 1 a 3 horas. El comienzo está marcado normalmente por nauseas extremas, seguidas de vómitos, que pueden ser severas. La diarrea se desarrolla algo más tarde (de una a unas pocas horas), y algunas personas sufren dolor abdominal. Algunas personas han sido hospitalizadas, pero normalmente la recuperación es rápida (3 4 hs después del comienzo de los síntomas) y espontánea. El curso de la enfermedad es rápido. Todos los síntomas normalmente se resuelven varias horas después del comienzo. El vómito normalmente se describe como abundante, y la severidad de los síntomas se relaciona directamente con la dosis de toxina (número de judías crudas ingeridas). La hospitalización se ha dado ocasionalmente, y puede que se tengan que administrar fluidos intravenosos. Aunque son de poca duración, los síntomas son extremadamente debilitantes. La diagnosis se hace en base a los síntomas, la historia alimentaria y la exclusión de otros agentes alimentarios venenosos de acción rápida (por ejemplo, Bacillus cereus, Staphylococcus aureus, arsénico, mercurio, plomo, y cianuro). El síndrome es probablemente esporádico, afectando a pequeños números de personas o individuos, y se diagnostica erróneamente de manera fácil o nunca se da noticia de ello debido a la corta duración de los síntomas. El síndrome normalmente es causado por la ingestión de judías crudas que han estado en remojo, ya sean solas o en ensaladas o guisos. La cantidad de cuatro o cinco judías ya pueden causar los síntomas.
Se han asociado varios brotes con los robots de cocina “crock pots”, o con guisos en los que la temperatura alcanzada no ha sido la suficiente para destruir la glicoproteína lectina. Se ha demostrado que al calentar hasta 80ºC se puede multiplicar la toxicidad por cinco, así que estas judías son más tóxicas si se comen crudas. En estudios de guisos cocinados en robots de cocina, la temperatura interna, normalmente no ha excedido los 75ºC. El cocinado adecuado destruye las lectinas, pero el cocinado no adecuado, como se ha mencionado arriba, puede incrementar la toxicidad inicial. Todas las personas, sin influir la edad o el género, parecen ser igualmente susceptibles; La severidad se relaciona solamente con la dosis ingerida. Las lectinas son glicoproteínas, presentes tanto en animales como en vegetales bacterias o virus, que se caracterizan por ser capaces de unirse a carbohidratos específicos, libres o que forman parte deglicanos de de glicoproteinas.
Si estos carbohidratos se encuentran en las membranas de loe eritrocitos, las lectinas que los reconocen provocan su aglutinación, por lo que reciben el nombre de hemaglutininas, fitohemaglutininas en el caso de ser lectinas vegetales. La primera lectina, extremadamente tóxica, fue descubierta por Stillmark en 1888, en las semillas del ricino, y se les dio el nombre de “lectinas” en la década de 1950, pero por el momento no se sabe exactamente cuál puede ser su función biológica. Es posible que sea muy diversa, desde el reconocimiento del propio polen a la defensa frente a insectos. Independientemente de esto, las lectinas son heramientas muy utilizadas en bioquímica, para el estudio de glicoproteínas, así como en biología celular y en investigación médica. Aunque existen lectinas en todos los cereales y leguminosas, desde el punto de vista de la Ciencia y la Tecnología de los Alimentos, las fitohemaglutininas más importantes son las presentes en las alubias y habas, ya que pueden dar lugar a intoxicaciones si no se cocinan adecuadamente.
Existen al menos cuatro, muy parecidas, designadas con las letras E (que aglutina eritrocitos), L (aglutina leucocitos), P y M. No se conoce exactamente la estructura que reconocen las lectinas de alubia pero son oligosacáridos complejos que incluyen restos de N-acetil-alfa -D-galactosamina unidos a otros monosacáridos, probablemente de diferente forma para cada lectina. Su unión no se ve inhibida por la presencia de ningún monosacárido, como sucede con otras lectinas. El peso molecular de estas lectinas es de alrededor de 128.000, y están formadas por la unión, no covalente, de cuatro subunidades distintas. Cada subunidad lleva unidos, muy próximos, un átomo de calcio y otro de manganeso, que son indispensables para el mantenimiento de su actividad. Cuando se ingieren leguminosas con fitohemaglutininas, éstas, se unen a las membranas de las células del tubo digestivo, produciendo rápidamente nauseas y vómitos, y a veces posteriormente diarrea y molestias abdominales. La enfermedad remite espontáneamente en pocas horas.
Las fitohemaglutininas son especialmente abundantes en las judías rojas (Phaseolus vulgaris), hasta el extremo de que bastan media docena de judías mal cocinadas para producir efectos nocivos. Las alubias blancas contienen solamente alrededor de un tercio de la cantidad de toxina que tienen las rojas, y las habas menos del 10%. Las fitohemaglutininas se desnaturalizan por calentamiento, por lo que desaparecen (en un 99%) si las legumbres se han cocinado correctamente, Ahora bien, un tratamiento térmico inadecuado (a una temperatura del orden de los 80º C) multiplica su acción tóxica. La intoxicación por alubias rojas es relativamente frecuente en Gran Bretaña, donde, al utilizarse en ensaladas, se cocinan con menos intensidad. En el maní (Arachis hypogaea) existe una lectina, también tetramérica, como la de la alubia roja, que es capaz de reconocer unidades de beta-D-galactosa. También son abundantes en lentejas, guisantes, soja y trigo germinado. Las lectinas de soja tienen afinidad por oligosacáridos que incluyen galactosa, las de lenteja, guisante y haba tienen afinidad por grupos de manosa, y las de patata y trigo germinado, por grupos de n-acetil quitobiosa. En ninguno de estos casos se conocen intoxicaciones debidas a ellas.
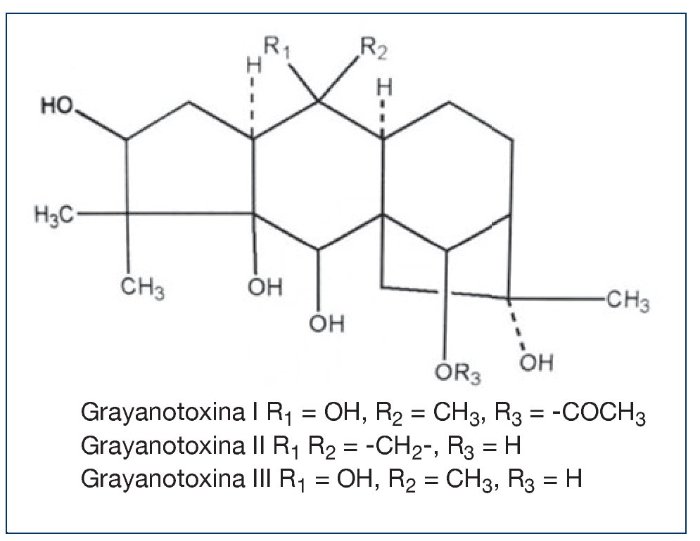
GRAYANOTOXINA
La grayanatoxina (antes conocida como andromedotoxina, acetylandromedol, y rhodotoxina) causa la “Intoxicación por Miel”. La intoxicación por miel es causada por el consumo de miel producida con el néctar de los rododendros. Las grayanotoxinas causan la intoxicación. Puede que las grayanotoxinas específicas varíen con la especia de planta. Estos compuestos son diterpenos, hidrocarburos cíclicos polihidroxilados que no contienen nitrógeno. Otros nombres asociado con la enfermedad con envenenamiento por rododendro, intoxicación de la miel loca o envenenamiento por grayanotoxina. El envenenamiento por grayanotoxina en humanos no es frecuente. Sin embargo, se deberían anticipar los casos de intoxicación con miel, en todas partes.
Esta intoxicación raramente es fatal y generalmente no dura más de 24 horas. Generalmente la enfermedad induce vértigos, debilidad, transpiración excesiva, nausea, y vómitos poco tiempo después de la ingestión de la miel tóxica. Otros síntomas que pueden ocurrir son baja presión sanguínea o shock, bradiarritmias, ritmo bajo en el seno, con un ritmo cardíaco de menos de 60), ritmo nodular (perteneciendo a un nódulo, particularmente el nódulo atrioventricular), síndrome de Wolff Parkinson White (excitación anómala atrioventricular) y bloqueo completo atrioventricular. Las grayanotoxinas se unen a los canales de sodio en las membranas celulares. Estos compuestos previenen la inactivación; por lo tanto, las células excitables (nervio y músculo) se mantienen en un estado de despolarización, durante el cual se puede facilitar la entrada de calcio en las células.
Esta acción es similar a la ejercida por los alcaloides de veratrum y aconitum. Todas las respuestas observadas de los músculos cardíacos y óseos, los nervios, y el sistema nervioso central están en relación con los efectos de la membrana. Como la intoxicación es pocas veces fatal y la recuperación generalmente se da dentro de 24 horas, puede que no se necesite intervención. El envenenamiento por grayanotoxina resulta frecuentemente de la ingestión de miel contaminada con grayanotoxina, aunque puede resultar de la ingestión de hojas, flores y néctar de rododendro. No todos los rododendros producen grayanotoxinas. El Rhododendron ponticum crece de manera extensiva en las montañas del este del Mar Negro, de Turquía. Estas especies se han asociado con el envenenamiento mediante miel desde el 401 A .C. Otras especies de rododendros y otros miembros de la familia botánica de las Ericaceae , a la que pertenecen los rododendros, pueden producir toxinas, pero generalmente no están implicadas con esta enfermedad. El laurel de montaña (Kalmia latifolia ) y el laurel de oveja (Kalmia angustifolia ) probablemente sean las fuentes más importantes de la toxina. El deseo incrementado del público por los alimentos naturales (sin procesar), puede resultar en más casos de envenenamiento por grayanotoxina. Los individuos que obtengan miel de los granjeros que pude que solo tengan unas pocas urticarias, están sometidos a un riesgo mayor, especialmente cuando la miel ha sido recolectada de las plantas mencionadas anteriormente. La unión de cantidades masivas de miel durante el procesado comercial generalmente diluye cualquier sustancia tóxica. Todas las personas que creen que pueden ser susceptibles a una intoxicación por miel.
Con todo, las toxinas no son concentradas como en las plantas que crecen en regiones húmedas a nivel del mar o bien en zonas montañosas áridas. Las especies de Rododendron cultivadas en parques y jardines tienen una cantidad mínima de toxina, es imprudente comer las hojas coriáceas, pero ninguna intoxicación con miel proveniente de estos híbridos se ha asociado debido a sus suaves toxinas. La radiación gamma constituye una de las técnicas profilácticas no destructivas para el control de enfermedades avícolas. Aunque ya se contaba con estándares internacionales para niveles permitidos de pesticidas en alimentos como leche, frutas y verduras, la miel había quedado en un segundo plano. Los controles de plaguicidas en miel no ha sido realizados regularmente, por no haber detectado el riesgo de contaminación. Gas y cromatografía líquida se unen para facilitar la seguridad del polen, las abejas y la cera, técnicas utilizadas por su especificidad, selectividad y sensibilidad y por la posibilidad de detectar pequeñas concentraciones de fármacos en la muestra que se analiza. Si bien el control sanitario de las enfermedades avícolas suele realizarse a través de sustancias químicas como antibióticos, con el consiguiente riesgo para contaminar las colmenas, la radiación gamma es una técnica profiláctica no destructiva apta para el control de enfermedades.
TETRODOTOXINAS
Ciertas especies tropicales de peces globo desarrollan en su hígado o intestinos una toxina, llamada tetrodotoxina, que puede producir intoxicaciones a las personas que los consumen. Los síntomas más característicos, que suelen ocurrir al cabo de dos o tres horas después de la ingestión, son el adormecimiento de la lengua y de la boca, mareo, dolor en la cabeza o caminar vacilante. En fases más avanzadas se va produciendo una parálisis general con posibilidad, si no se actúa rápidamente, de parada cardiorrespiratoria y muerte al cabo de 4 o 6 horas. Es una intoxicación extremadamente grave que produce la muerte en la mitad de las personas afectadas. La tetrodotoxina es un compuesto tóxico producido por el pez globo. El envenenamiento por consumo de miembros del orden Tetraodontiformes es una de las intoxicaciones más violentas de especies marinas. Las gónadas, el hígado, los intestinos y la piel del pez globo pueden contener el nivel suficiente de tetrodotoxina como para causar una muerte rápida y violenta. La carne de muchos peces globo no suele ser tóxica hasta un nivel peligroso.
La tetrodotoxina también se ha aislado de especies animales muy diferentes, incluidas el tritón de California, el pez loro, las ranas de género Atelopus, los pulpos de anillos azules, las estrellas, los peces ángel y el cangrejo xántido. La fuente real de la tetrodotoxina es incierta. No se ha identificado su origen en ningún alga, y hasta hace poco se asumía que la tetrodotoxina era un producto metabólico del huésped. Sin embargo, trabajos recientes sobre la producción de tetrodotoxina /anhidrotetrodotoxina por varias especies bacterianas, incluyendo cepas de las familias Vibrionaceae, Pseudomonas s p., y Photobacterium phosphoreum, apuntan a que esta familia de toxinas tiene origen bacteriano. Estas bacterias marinas relativamente comunes, normalmente están asociadas a animales marinos. Si se confirmaran, estos descubrimientos tendrían algún significado en toxicosis que se han relacionado más directamente con estas especies bacterianas.
El primer síntoma de la intoxicación es un ligero adormecimiento de los labios y la lengua, que aparecen entre 20 minutos y 3 horas después de haber comido pez globo venenoso. El siguiente síntoma es una parestesia creciente en la cara y en las extremidades, a la que pueden seguir sensaciones de ligereza, o de estar flotando. Puede haber migrañas, dolor epigástrico, nauseas, diarrea y vómitos. Ocasionalmente, puede darse cierto tambaleo o dificultad al caminar. La segunda etapa de la intoxicación es una parálisis creciente. Muchas víctimas no son capaces de moverse; incluso el estar sentado puede resultar difícil. Se da dolor respiratorio creciente. El habla se ve afectada, y la víctima habitualmente exhibe cianosis, e hipotensión. La parálisis aumenta y puede que se den convulsiones, discapacidad mental, y arritmias cardíacas. La víctima, aunque está completamente paralizada, puede ser consciente y en algunos casos estar completamente lúcido hasta poco antes morir. La muerte se da normalmente entre 4 y 6 horas, con un rango de entre 20 minutos y 8 horas.
El diagnóstico del envenenamiento por consumo de pez globo se basa en observar la sintomatología y la historia alimentaria reciente. Los envenenamientos de tetrodotoxina se han asociado casi exclusivamente con el consumo de peces globo de aguas de las regiones del océano Indo Pacífico. Se han informado de varios casos de envenenamiento, casos fatales incluidos, relacionados con peces globo del océano Atlántico, el golfo de México y el golfo de California. No se ha confirmado ningún caso de envenenamiento con peces globo del Atlántico, Spheroides maculatus. Las caracolas Charonia sauliae han estado implicadas en envenenamientos alimentarios, y hay evidencias que sugieren que contienen un derivado de la tetrodotoxina. Se estima un total de unos 200 casos al año de los que se ha informado de una mortalidad que se acerca al 50%, prácticamente todos en Japón, ya que los casos en países fuera del área Indo Pacífica son muy escasos.
Esta toxicosis se puede evitar no consumiendo paz globo u otras especies animales que no contengan tetrodotoxina. Se sabe que muchas otras especies animales contienen tetrodotoxina y normalmente no son consumidas por humanos. Todos los humanos son susceptibles de envenenarse con tetrodotoxina. El envenenamiento con tetrodotoxina es una preocupación sanitaria de primer orden en Japón, donde el “fugu” es una delicia tradicional. Se prepara y vende en restaurantes especiales donde individuos entrenados y con licencia quitan las vísceras con cuidado para reducir el riesgo de envenenamiento. La importación de pez globo a países europeos o a Estados Unidos no está permitida por lo general, aunque puede que se den excepciones especiales. En productos de pescado congelado o preparado, puede darse tanto un mal etiquetado como una identificación incorrecta.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.