LAS ENFERMEDADES TRANSMITIDAS POR LOS ALIMENTOS (Parte 17)
ETA(s) PRODUCIDAS por MICOTOXINAS
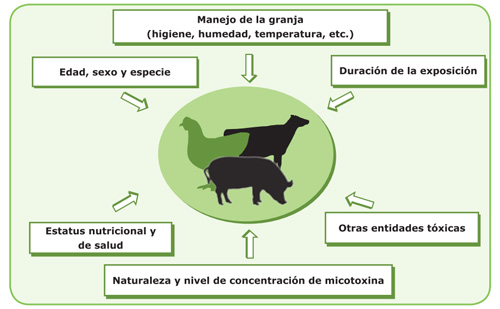
Las micotoxinas pueden contaminar los alimentos y/o los piensos, y las materias primas utilizadas para su elaboración, de forma tal que, al consumir dichos alimentos o piensos contaminados, origina en el ser humano y en los animales un trastorno toxicológico denominado micotoxicosis. La gravedad de las micotoxicosis depende de una serie de factores: Toxicidad de la micotoxina, biodisponibilidad y concentración de la misma en el alimento, sinergismos entre las micotoxinas presentes en el mismo alimento, o en varios alimentos componentes de la dieta del consumidor, cantidad de alimento consumido, continuidad o intermitencia en la ingestión del alimento contaminado, peso del individuo, edad y estado fisiológico del mismo. Aunque, se reconozcan como micotoxinas 800 compuestos, sólo 30 tienen propiedades tóxicas de importancia, variando la toxicidad de unas a otras, pero las más tóxicas son la Aflatoxina B1, la Ocratoxina A y la Zearalenona por su genotoxicidad (alteración material genético) y carcinogeneidad. Además, es de especial importancia la Aflatoxina M1, micotoxina derivada de la Aflatoxina B1, que es excretada en la leche de las hembras de los mamíferos por ingesta de piensos contaminados. Las micotoxinas son contaminantes químicos producidos por una serie de hongos que atacan los cultivos en campo, principalmente de cereales, frutos secos y frutas. Pueden entrar en la cadena alimentaria de forma directa a través del consumo de cereales, frutos secos y frutas, y sus productos elaborados, o de forma indirecta a través del consumo de productos de origen animal (carne, huevos y leche) como consecuencia del consumo de pienso contaminado.
Son sustancias producidas por ciertos hongos pertenecientes principalmente a los géneros Aspergillus, Fusarium y Penicillium. Suelen encontrarse en una gran variedad de productos agrícolas, y son los contaminantes naturales de los alimentos más extendidos a nivel mundial. Son altamente tóxicos, producen mutaciones (mutágenos), producen cáncer (cancerígenos), malformaciones en los fetos (teratógenos) y disminuyen la inmunidad (inmunosupresores). Debido a su gran variedad de efectos tóxicos, y sobre todo a su extrema resistencia al calor (termorresistencia), la presencia de las micotoxinas en los alimentos es considerada de alto riesgo para la salud humana y de los animales. La contaminación de los alimentos con micotoxinas depende de las condiciones ambientales, que pueden propiciar el crecimiento del hongo y por ende la producción de las toxinas. Por tanto, la mayoría de los productos agrícolas pueden ser susceptibles de contaminación casi en cualquier momento, desde su producción en el campo, durante la cosecha, en el transporte y en el almacenamiento. La información respecto a la incidencia y los niveles de contaminación por micotoxinas en los alimentos está limitada por muchos factores, entre ellos los recursos disponibles para realizar investigaciones, las facilidades de los laboratorios para llevar a cabo los análisis, lo adecuado de los procedimientos de muestreo y la sensibilidad de los métodos de cuantificación utilizados.
De la extensa variedad de micotoxinas, alrededor de una veintena han sido particularmente investigadas, y seis de ellas, se consideran importantes desde el punto de vista de las toxiinfecciones alimentarias.
AFLATOXINAS
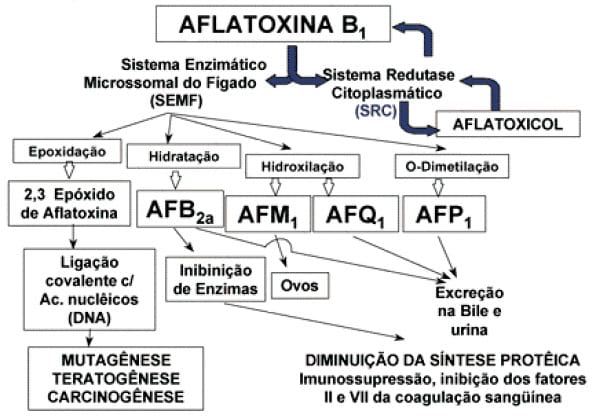
Las aflatoxinas son metabolitos tóxicos producidos por Aspergillus flavus o A. parasiticus en los alimentos y piensos. Son probablemente las micotoxinas más conocidas y las que se investigan más intensamente del mundo. Las aflatoxinas han sido asociadas a varias enfermedades, tales como aflatoxicosis, en ganado, animales domésticos y humanos por todo el mundo. La presencia de aflatoxinas depende de ciertos factores ambientales; y además el nivel de contaminación variará con la localización geográfica, de las prácticas agriculturales y agronómicas, y de la susceptibilidad de las instalaciones a la invasión por parte de los hongos antes de los periodos de cosecha, del almacenaje, y del procesado. Las aflatoxinas han recibido mayor atención que cualquier otro tipo de micotoxinas porque han demostrado tener un potente efecto carcinógeno en animales de laboratorio susceptibles, y efectos toxicológicos agudos en humanos. Así como la seguridad total nunca se puede alcanzar, muchos países han intentado limitar la exposición a las aflatoxinas imponiendo límites en las regulaciones de las instalaciones destinadas a los alimentos y a los piensos. En la década de los 60, más de 100.000 pavos jóvenes en granjas de aves en Inglaterra murieron en el transcurso de unos meses debido aparentemente a una enfermedad nueva, que fue llamada “la enfermedad X del pavo”. Pronto se encontró que esta dificultad no estaba limitada a los pavos. Tanto pollos jóvenes como faisanes jóvenes fueron también afectados y se dio una alta mortalidad. Una encuesta cuidadosa de los primeros brotes mostró que todo estaba asociado con los piensos, el denominado “Pienso de cacahuete brasileño”. Una intensa investigación del pienso a base de cacahuete sospechoso se realizó y pronto se encontró que este cacahuete era altamente tóxico para las aves de corral y los patos jóvenes con los síntomas de “la enfermedad X del pavo”. Se hicieron especulaciones durante los 60 respecto a la naturaleza de la toxina y se sugirió que era de origen fúngico.
De hecho, el hongo productor de la toxina se identificó como Aspergillus flavus (1961) y a la toxina se le dio el nombre de Aflatoxina en virtud de su origen A. flavus > Afla. Este descubrimiento llevó a una que creciera la conciencia acerca de los peligros potenciales de estas sustancias como contaminantes de alimentos y piensos que pueden causar enfermedad o incluso muerte en humanos y otros mamíferos. Unos estudios revelaron que las aflatoxinas las producen principalmente algunas cepas de A. flavus y la mayoría, si no todas, de cepas de de A. parasiticus. Hay cuatro aflatoxinas principales: B1, B2, G1, G2. Donde la designación de aflatoxinas B1 y B2 viene de que bajo la luz ultravioleta exhiben fluorescencia azul, mientras que las designadas como G se refiere a que muestran en sus estructuras relevantes fluorescencia amarilla verdosa bajo la luz ultravioleta. Además, dos de los productos metabólicos, aflatoxina M1 y M2, son contaminantes directos significativos de alimentos y piensos. Éstos fueron los primeros en ser aislados de la leche (milk) de animales lactantes alimentados con preparaciones de aflatoxina; de ahí la designación de M. Estas toxinas tienen estructuras muy parecidas y forman un grupo único de compuestos heterocíclicos altamente oxigenados, de forma natural.
Las aflatoxinas normalmente se desarrollan en los cultivos, en el campo, antes de la cosecha. La contaminación postrecolección puede ocurrir si el secado de la cosecha se retrasa y mientras el cultivo está almacenado se permite que la cantidad de agua exceda los valores críticos para el desarrollo de mohos. Infestaciones de insectos o de roedores facilitan la invasión de mohos en ciertas instalaciones de almacenaje. Las aflatoxinas se detectan ocasionalmente en leche, queso, maíz, cacahuetes, semillas de algodón, nueces, almendras, higos, especias, y gran variedad de otros alimentos y piensos. Leche, huevos y productos cárnicos, a veces se contaminan debido a que el animal ha consumido piensos contaminados con aflatoxinas.
Sin embargo, los bienes con el mayor riesgo de contaminación por aflatoxina son el maíz, los cacahuetes, y las semillas de algodón. El crecimiento fúngico y la contaminación por aflatoxinas son consecuencia de las interacciones entre los hongos, el huésped, y el entorno. La combinación apropiada de estos factores determina la infección y colonización del sustrato, y el tipo y la cantidad de aflatoxina producida. Sin embargo, se requiere un sustrato adecuado para que el hongo crezca y produzca la toxina, aunque los factores precisos que inician la formación de toxinas no se comprenden bien. La falta de agua, temperatura demasiado alta, y daños causados por insectos en la planta huésped son los principales factores que determinan la infección por mohos y la producción de toxinas. De forma similar, las diferentes etapas de crecimiento del cultivo, la poca fertilidad, grandes densidades de cultivo, y la competitividad entre hierbas, se han asociado a un crecimiento fúngico y a una producción de toxinas mayor. La formación de aflatoxinas también se ve afectada por el crecimiento asociado de otros mohos y microbios. Por ejemplo, la contaminación con aflatoxinas antes de la cosecha en cacahuetes y maíz se ve favorecida por las altas temperaturas, periodos de sequía prologados y alta actividad de insectos, mientras que la producción de aflatoxinas después de la cosecha en cacahuetes y maíz se ve favorecida por temperaturas cálidas y humedad alta.
Los brotes de aflatoxicosis en animales de granja se notifican en muchas partes del mundo. En estos brotes, principalmente es el hígado el que se ve afectado, incluso en estudios experimentales con animales, incluyendo primates no humanos. Las lesiones agudas de hígado, caracterizadas por la necrosis de los hepatocitos y la proliferación biliar, y las manifestaciones crónicas pueden incluir fibrosis. Un nivel de aflatoxina en el pienso tan bajo como 300 μg/kg puede inducir aflatoxicosis crónica en cerdos en 34 meses. La aflatoxina B1 es un carcinógeno del hígado en al menos 8 especies entre las que se incluyen primates no humanos. Se han establecido relaciones dosis respuesta en estudios con ratas y truchas arco iris, con un 10% de incidencia en tumores que son esperables en niveles de aflatoxina B1 de 1 μg/kg, y 0.1 μg/kg, respectivamente. En algunos estudios se han observado carcinomas de colon y de riñón en ratas tratadas con aflatoxinas. La toxicidad aguda y la carcinogenicidad de las aflatoxinas es mayor en ratas macho que en hembras; puede que las implicaciones hormonales sean las responsables de esta diferencia ligada al sexo. El estado nutricional de los animales puede modificar la expresión tanto de la toxicidad aguda, como de la carcinogenicidad, o de ambas. Hay poca información acerca de la asociación de la hepatoxicidad aguda en el hombre con respecto a la exposición a aflatoxinas, pero se han encontrado casos de daño agudo del hígado que posiblemente puedan ser atribuidos a aflatoxicosis agudas.
Un brote de hepatitis aguda en distritos adyacentes de dos estados vecinos en el noroeste de India, que afectaron a varios cientos de personas, aparentemente estaban asociados con la ingestión de maíz altamente contaminado. Algunas de estas muestras contenían niveles de aflatoxina en el rango de mg/kg, en el que el mayor nivel registrado fue de 15 mg/kg. El cáncer de hígado es más común en algunas regiones de África y del sudeste asiático que en otras partes del mundo, y cuando se considera la información epidemiológica junto con los datos de experimentación en animales, parece que una mayor exposición a las aflatoxinas puede incrementar el riesgo de cáncer primario de hígado. Datos conjuntos de Kenia, Mozambique, Swazilandia, y Tailandia muestran una correlación positiva entre la ingesta diaria de aflatoxina con la dieta (en el rango de 3.5 a 222.4 ng/kg de masa corporal por día) y la tasa bruta de incidencia de cáncer primario de hígado (en el rango de 1.2 a 13.0 casos por 100 000 personas por año). También hay alguna evidencia de la circunstancia vital en la etiología de la enfermedad. En vista de la evidencia que concierne a los efectos, particularmente al carcinógeno, de las aflatoxinas en varias especies animales, y en vista de la asociación entre los niveles de exposición y la incidencia en humanos de cáncer de hígado observada en algunas partes del mundo, la exposición a aflatoxinas debería mantenerse tan baja como sea posible en la práctica. Los niveles de tolerancia para los productos alimenticios que se han establecido en varios países deberían entenderse como una herramienta para facilitar la implementación de los programas de control de las aflatoxinas, y no como unos límites de exposición que necesariamente aseguran la protección de la salud. La Agencia Internacional para la Investigación en Cáncer clasificó a las aflatoxinas en el grupo 1 como sustancias (o mezclas) con alto poder cancerígeno en humanos.
La manera más eficiente de controlar la presencia de las aflatoxinas en los alimentos es evitar su formación. Prevenir la producción de las aflatoxinas en el campo no es tarea fácil; sin embargo, el riesgo se puede reducir mediante el uso de algunas prácticas culturales agronómicas desfavorables para el establecimiento del hongo en la mazorca. Por el contrario, la producción de las aflatoxinas durante el almacenamiento es un problema tecnológico, el cual puede solucionarse secando apropiadamente el grano antes del almacenamiento. La producción de aflatoxinas es un problema serio de salud pública asociado a materiales como el maní, pistachos, semillas del algodonero, nueces y copra (médula del coco). Pero es sobre todo un problema en el maíz, por su amplio uso en la alimentación humana y animal. Los alimentos con relativamente bajo riesgo de contaminación con aflatoxinas son las almendras, pasas, higos y especias. De estas últimas, las que han mostrado una mayor incidencia de contaminación con aflatoxinas son los chiles, pimentones y el jengibre. Los frijoles, soja, sorgo, trigo, avena y arroz son moderadamente susceptibles a la contaminación. Ocasionalmente, las aflatoxinas también contaminan granos de cacao, la linaza, las aceitunas, semillas de calabaza y girasol y el ajonjolí. Es casi imposible eliminar completamente las aflatoxinas de los alimentos mediante su procesamiento. Por consiguiente, al igual que otros carcinógenos, se sugiere que los niveles en los alimentos sean lo más bajos tecnológicamente posible. Durante el proceso de la nixtamalización del maíz para la elaboración de tortillas se ha reportado una aparente reducción (60 a 90 por ciento) en los niveles de aflatoxinas.
Sin embargo, también se ha sugerido que la acidificación puede revertir la reacción, tal y como puede ocurrir en el tracto digestivo humano durante la digestión. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), estableció en 1977 un límite permisible de 20 microgramos por kilogramo para las aflatoxinas totales en los alimentos destinados al consumo humano. Sin embargo, en algunos países europeos se han establecido límites de tolerancia más estrictos, específicamente para la AFB1, reglamentando 5 microgramos por kilogramo para los alimentos destinados tanto al consumo humano como animal.
FUMONISINAS
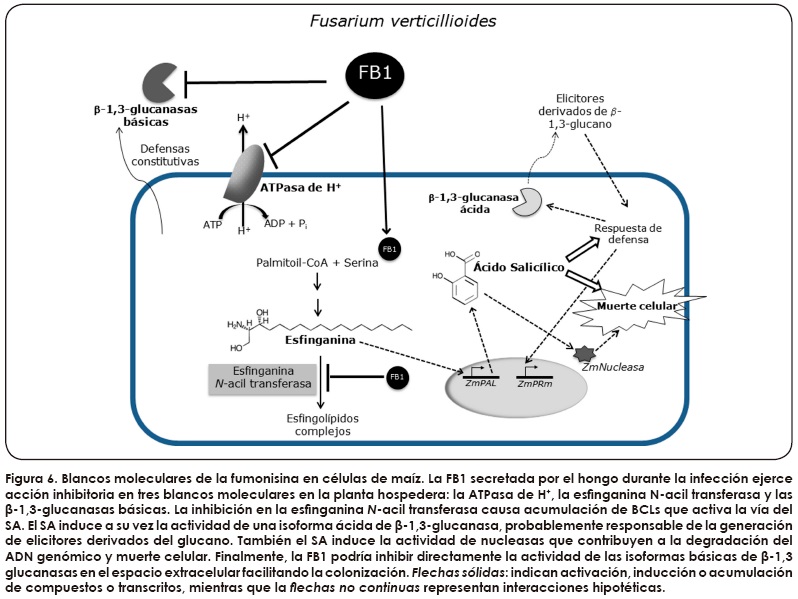
Las fumonisinas son un grupo de al menos 15 micotoxinas producidas principalmente por los hongos Fusarium verticilliodes y F. proliferatum, las cuales se en cuentran frecuentemente en todas las re giones productoras de maíz a nivel mundial. Existen al menos tres fumonisinas de ocurrencia natural: se conocen como FB1, FB2 y FB3. La FB1 es siempre la más abundante, seguida por la FB2 y la FB3. Generalmente estas toxinas se encuentran en los alimentos en concentraciones de partes por millón (miligramos por kilogramo). Este tipo de micotoxinas producen una gran variedad de efectos en los animales; leucoencefalomalacia (reblandecimiento de la sustancia blanca del cerebro) en equinos, edema (hinchazón) pulmonar en porcinos, así como toxicidad del riñón (neurotoxicidad) y cáncer de hígado en ratas. Su efecto en humanos ha sido difícil de determinar; sin embargo, se han asociado con una alta incidencia de cáncer de esófago y con la promoción de cáncer hepático en ciertas áreas endémicas de China. Con base en la evidencia toxicológica disponible, la Agencia Internacional para la Investigación en Cáncer clasificó a las fumonisinas B1 y B2 en el grupo 2B. Al parecer las fumonisinas se hallan en cualquier región en donde se cultive maíz, exceptuando algunas áreas frías, que pueden escapar ligeramente al problema de esta contaminación. Algunos de los alimentos procesados para consumo humano que frecuentemente presentan contaminación con fumonisinas son las harinas de maíz, las hojuelas de maíz y la sémola.
Por el contrario, los productos que suelen presentar bajos niveles de estas toxinas son el arroz, los frijoles, el sorgo, la cerveza y las especias. Las fumonisinas son relativamente estables y no son destruidas por tratamientos con calor moderado. Luego del tratamiento del maíz con hidróxido de calcio (nixtamalización) no se han detectado fumonisinas en las tortillas; sin embargo, debe ponerse atención a los productos degradados como la fumonisina hidrolizada, la cual puede ser tan tóxica como el compuesto original. Existen diferencias entre países respecto al límite de tolerancia establecido para las fumonisinas. Se ha propuesto 5 miligramos por kilogramo para proteger a los animales más susceptibles, como los caballos, y 50 miligramos por kilogramo para cerdos.
Sin embargo, pocos países han establecido límites de tolerancia para alimentos destinados al consumo humano, entre Las micotoxinas: contaminantes naturales de los alimentos Los productos agrícolas pueden contaminarse con micotoxinas, compuestos tóxicos producidos por hongos, en cualquier momento, desde su producción en el campo, durante la cosecha, en el transporte o en el almacenamiento. Un alimento invadido por hongos no siempre contendrá micotoxinas. A la inversa, no debe asumirse que los alimentos con bajas cuentas de hongos estén libres de micotoxinas. El uso de técnicas de manejo del maíz en el campo, puede ayudar a aminorar el problema de la contaminación por micotoxinas; sin embargo, nunca ofrecerán una solución total. ellos Suecia, que permite 1 miligramo por kilogramo para la suma de las fumonisinas B1 y B2 en el grano de maíz.
OCRATOXINAS
Las ocratoxinas son micotoxinas que afectan el sistema nervioso (neurotóxicas) y pueden causar cáncer de riñón (nefrocancerígenas).
Son producidas por el hongo Penicillium verrucosum en regiones con clima frío, y por algunas especies de Aspergillus (como A. ochraceus) en regiones con clima tropical. La mayoría de estos hongos producen principalmente ocratoxina A y raras veces ocratoxina B. La Agencia Internacional para la Investigación en Cáncer (IARC) clasificó a la ocratoxina A en el grupo 2B, como una sustancia posiblemente cancerígena en humanos. Las ocratoxinas, son moléculas moderadamente estables y por tanto suelen resistir la mayoría de los procesos de elaboración de los alimentos, como el hervido, el tostado, el horneado, el freído y la fermentación. Se estima que la ingesta diaria de este tipo de micotoxinas en humanos se encuentra entre 0.7 y 4.7 nanogramos (milmillonésimas de gramo) por kilogramo de peso corporal. De ella, cerca del 50 por ciento es atribuida al consumo de cereales y sus productos derivados. La ocurrencia natural de la ocratoxina A es evidente en la mayoría de los cereales como maíz, trigo, cebada, sorgo, arroz, avena y centeno. Sin lugar a duda la ocurrencia de este tipo de micotoxina está asociada con las condiciones climáticas, y sobre todo con las condiciones de cosecha y manejo poscosecha de los granos. Las concentraciones usualmente encontradas están por debajo de los 50 microgramos (milésimas de gramo) por kilogramo; sin embargo, se pueden presentar niveles más altos, sobre todo cuando los productos son almacenados bajo condiciones inadecuadas.
Las ocratoxinas también se han encontrado en otros alimentos como los frijoles, la soja, el café, las nueces, los frutos secos, el cacao, los jugos y los vinos de uva, la cerveza y en algunas especias. La OMS, establece un límite máximo de tolerancia de 5 microgramos por kilogramo para los cereales no destinados al consumo humano; 3 microgramos por kilogramo para los destinados al consumo humano; 3 microgramos por kilogramo para los granos de café tostado; 10 para el vino procedente de frutos deshidratados; 2 para los granos de cacao; 0.5 para el vino de mesa y los jugos de uva, y 0.2 microgramos por kilogramo para la cerveza. La ocratoxina A, el compuesto principal, se ha encontrado en más de 10 países, entre ellos Europa y Estados Unidos. La ocratoxina producida por Aspergillus parece estar limitada por condiciones de alta humedad y temperatura. Sin embargo, algunas especies de Penicillium pueden producir ocratoxina a temperaturas menores de los 5°C. Se ha encontrado en el maíz, la cebada, el trigo y la avena, sin embargo, la presencia de ocratoxina B es poco común. Residuos de ocratoxina A han sido identificados en los tejidos de cerdos en mataderos. Se ha demostrado, bajo condiciones experimentales, que estos residuos aún pueden ser detectados en los tejidos de los cerdos un mes después de haber sido expuestos a esta toxina. Los efectos toxicológicos de la ocratoxina A han sido estudiados extensamente en un gran número de estudios experimentales usando animales. Todos los animales estudiados hasta ahora han sido susceptibles a la ocratoxina A administrada vía oral, pero en diferentes grados. Altos niveles de ocratoxina A mostraron cambios en los riñones, otros órganos y en los tejidos.
No obstante, sólo se observaron lesiones renales a niveles de exposición idénticos a los que ocurren ambientalmente. En alimentos para animales niveles tan bajos como 200 μg/kg produjeron cambios renales durante el transcurso de 3 meses en ratas y cerdos . Casos en el campo que presentan nefropatía inducidos por ocratoxina A se presentan por lo general en cerdos y aves de corral. La ocratoxina A es teratogénica en ratones, ratas y hamsters. La ocratoxina B, raramente encontrada como contaminante natural, es menos tóxica; las demás ocratoxinas nunca han sido descubiertas en productos naturales. El potencial nefrotóxico de la ocratoxina A ha sido bien documentado en base a estudios experimentales hechos en alimentos para animales a niveles de 200 μ g/kg, causando nefropatía en cerdos y ratas. Niveles más bajos aún no han sido estudiados. Casos de nefropatía inducida por ocratoxina A en animales de granja han sido reconocidos desde hace algún tiempo. Esta toxina ha sido encontrada en una variedad de productos alimenticios. En productos básicos usados como alimento para animales se han encontrado niveles de 27 mg/kg. En el caso de alimentos para consumo humano los niveles han estado alrededor de 100 μ g/kg. En una zona donde la nefropatía endémica era prevalente en la población, los alimentos producidos en el hogar estaban contaminados con ocratoxina A con mayor frecuencia que áquellos de las áreas de control. Sin embargo, el consumo total de ocratoxina.
A por el ser humano no ha sido determinado todavía. Por lo tanto, hoy en día no existe evidencia de que la ocratoxina A esté relacionada con enfermedades humanas.
PATULINAS
La patulina es un compuesto tóxico producido por una gran variedad de especies de hongos de los géneros Aspergillus y Penicillium.
De ellos, P. expansum es el más importante, pues es un contaminante común de las manzanas y otros frutos. Se ha reportado que la patulina posee actividad antibiótica, la cual ha sido eva luada en humanos para probar su utilidad en el tratamiento de los resfríos comunes; sin embargo, su efectividad aún no ha sido claramente demostrada debido a que es altamente irritante al estómago y además suele ocasionar náuseas y vómito. La Agencia Internacional para la Investigación en Cáncer clasificó a la patulina en el grupo 3. Bajo ciertas condiciones de laboratorio, la patulina se ha logrado producir en manzanas, jugo de uva, cereales y en algunos quesos. Sin embargo, en situaciones naturales, la patulina es un contaminante típico de las manzanas, del jugo y de la sidra. Otros productos a base de manzanas, como tartas y mermeladas, también suelen contener pequeñas cantidades. Ocasional mente la patulina ha sido encontrada en frutos con pudrición espontánea como plátanos, peras, piñas, duraznos y tomates; sin embargo, los niveles reportados generalmente han sido relativamente bajos.
Generalmente, la patulina no se encuentra en bebidas alcohólicas ni en vinagre; sin embargo, se la ha encontrado en la sidra dulce (la cual se combina con jugo de manzana no fermentado). Además, se sabe que la patulina es degradada por el dióxido de azufre (SO2), el cual se emplea comúnmente como conservador en los jugos de frutas y otros alimentos. La patulina no ha sido sujeta a regulación en la mayoría de los países; sin embargo, la calidad del jugo de fruta (manzana) es controlada por algunos de ellos, que han establecido una concentración máxima de 50 microgramos por litro.
TRICOTECENOS
Los tricotecenos son unas toxinas que pertenecen a un grupo de compuestos químicos cercanos entre sí producidos por varias especies de Fusarium, Cephalosporium, Myrothecium, Trichoderma y Stachybotrys.
Se han detectado cuatro tricotecenos (Toxina T2, nivalenol, desoxinivalenol (DON), y diacetoxiscirpenol) como contaminantes naturales en un pequeño número de muestras alimentarias. El desoxinivalenol es el más común, pero menos tóxico de estos compuestos. Los tricotecenos son inhibidores fuertes de la síntesis de proteínas en las células de mamíferos. Sin embargo, el desoxinivalenol recibe su nombre común, vomitoxina, por los vómitos que normalmente acompañan en envenenamiento por tricotecenos. El DON es, probablemente, el tricoteceno que más frecuentemente se detecte, y la toxina es producida por F. graminearum y F. culmorum . Las dos especies de Fusarium son patógenos vegetales, y causan brotes de golpe blanco del trigo. Los brotes más serios de la enfermedad ocurren en años con lluvias intensas durante la estación de florecimiento. En una media mundial, el DON se ha encontrado en un 57% de las muestras de trigo, 40% de maíz, 68% de las muestras de avena, 59% de cebada, 48% de las muestras de centeno y 27% de las muestras de arroz analizadas. También se encontró DON en productos a base de trigo y de maíz, como por ejemplo en harina, pan y cereales para el desayuno. Las concentraciones de DON en muestras de cereales aleatorias mostraron una gran variación anual, con concentraciones que variaban desde por debajo de los límites de detección 550 μg/kg) hasta más de 30 mg/kg.
El nivalenol es más común en Europa, Australia y Asia que en América. Los niveles tanto de cantidad media como de incidencia de muestras positivas en nivalenol son más bajas que las de DON. La toxina T2 se ha encontrado en muchos productos diferentes, pero normalmente en cantidades muy pequeñas. Se ha informado en Rusia de un posible papel de los tricotecenos en la enfermedad humana Aleukia Tóxica Alimentaria (ATA). La enfermedad ha sido seguida desde el siglo XIX, y se dio un brote fuerte en el distrito de Orenburg durante 1942 y 1947, donde 100 000 personas murieron. La enfermedad se atribuyó al consumo de trigo almacenado al aire libre, infectado con Fusarium La enfermedad se caracterizaba por causar puntos en la piel, angina necrótica, leucopenia extrema, y múltiples hemorragias y agotamiento de la médula ósea. Más tarde se vio muestras aisladas de Fusarium sporotrichioides y F. poae de trigo, producían toxina T2 y estaban relacionadas con los tricotecenos (Yagen & Joffe, 1976). También se observaron síntomas similares a los que mostraban los pacientes que sufrían ATA, en animales expuestos a dosis tóxicas y agudas de toxina T2. Los tricotecenos también se han asociado a brotes de desórdenes gastrointestinales humanos en Japón. La toxicidad de los tricotecenos es caracterizada por alteraciones gastrointestinales como vómito y diarrea; además, este grupo de micotoxinas son extremadamente tóxicas a nivel celular (citotóxicas) así como altamente inmunosupresoras.
A la fecha, ha identificado a poco más de 150 diferentes tricotecenos; sin embargo, la información de su ocurrencia natural en los alimentos es escasa, y generalmente se refiere al desoxinivalenol (vomitoxina), al nivalenol y a la toxina T-2. La Agencia Internacional para la Investigación en Cáncer identificó al desoxinivalenol, al nivalenol, y a la fusarenona X en el grupo 3. La legislación de los tricotecenos existe solamente en pocos países, ya que estos compuestos se presentan en los alimentos como una mezcla de toxinas (con diferentes grados de toxicidad) y sobre todo a diferentes concentraciones. Dijimos anteriormente, que el Desoxinivalenol (DON), es uno de los 150 compuestos conocidos como tricotecenos, y su toxicidad ha sido difícil de relacionar con los resultados experimentales de situaciones reales, debido a que generalmente se presenta acompañado de otros tipos de tricotecenos. En particular, la toxicidad del desoxinivalenol se caracteriza por vómito y diarrea, mientras que en una intoxicación aguda puede observarse necrosis en el tracto gastrointestinal y en los tejidos linfoides. Frecuentemente se detectan cantidades significativas de desoxinivalenol en maíz, avena, cebada y trigo; mientras que los niveles más bajos generalmente están asociados a materiales tales como el triticale (cruza de trigo y centeno), el centeno, el sorgo y el arroz. El desoxinivalenol es térmicamente estable y por tanto es difícil de eliminar una vez formado en los cereales. Sin embargo, es soluble en agua y puede eliminarse una cantidad considerable en los procesos que involucran el lavado. La Comunidad Europea estableció un límite para el desoxinivalenol de 0.5 miligramos por kilogramo para los cereales de consumo directo, y 0.75 miligramos por kilogramo para las harinas empleadas como materia prima.
ZEARALENONAS
Este tipo de micotoxina también es conocida como toxina F-2 o ZEN, y es producida por especies del hongo Fusarium, comúnmente F. graminearum y F. culmorum.
La zearalenona, un metabolito producido por varias especies del género Fusarium, ha sido hallada en varios países de Africa y Europa, además de los EEUU, como un contaminante de origen natural de los cereales, particularmente el maíz. El efecto más importante de la zearalenona es sobre el sistema reproductivo, causando exceso de producción de estrógenos (hiperestrogenismo), particularmente en las cerdas. Hay poca evidencia de que la zearalenona cause cáncer; sin embargo, la evidencia respecto a su capacidad de causar mutaciones (genotoxicidad) es contradictoria, pues se ha reportado que es genotóxica en ratones. La mayoría de estos estudios son totalmente dependientes de la especie evaluada, y por consiguiente se requiere de más investigación para confirmar que la zearalenona sea un carcinógeno potencial en humanos. La Agencia Internacional para la Investigación en Cáncer identificó a la zearalenona en el grupo 3, como una sustancia no clasificable como cancerígena en humanos. La zearalenona se encuentra principalmente en cereales como maíz, cebada, trigo y arroz. Sin embargo, la contaminación con zearalenona no se restringe únicamente a esos granos, pues también se la ha encontrado en cerveza, frijoles, plátanos y soja.
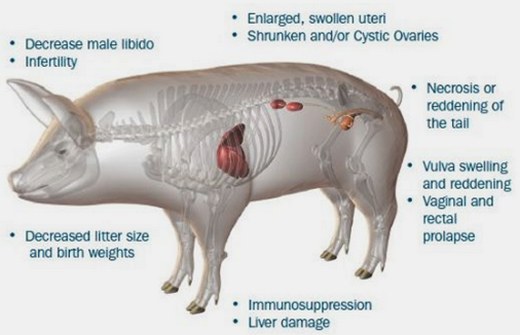
La zearalenona es parcialmente degradada por el efecto de la temperatura (120-140 grados Celsius) y por tanto siempre existirá un remanente en el alimento, aun después del procesamiento. Los límites de tolerancia para esta micotoxina han sido evaluados con base en los niveles a los cuales no poseen efectos hormonales en las cerdas. Consecuentemente, se han establecido tolerancias de hasta 1 microgramo por kilogramo para la mayoría de los cereales. Se ha demostrado que la zearalenona produce efectos estrogénicos en los animales, encontrándose además casos de un síndrome estrogénico específico en los cerdos y de infertilidad en el ganado vacuno en asociación con niveles de consumo de zearalenona de 0.16.8 mg/kg y 14 mg/kg respectivamente. Este compuesto también ha producido malformaciones congénitas en el esqueleto de las ratas. En algunos países la zearalenona ha sido hallada en muestras de alimentos preparados a base de maíz (granos y hojuelas) destinados al consumo humano, en niveles de hasta 70 m g/kg, correspondientes a dosis 4 x 105 veces más bajas que aquellas causantes de efectos en monos o ratones estudiados bajo condiciones experimentales.
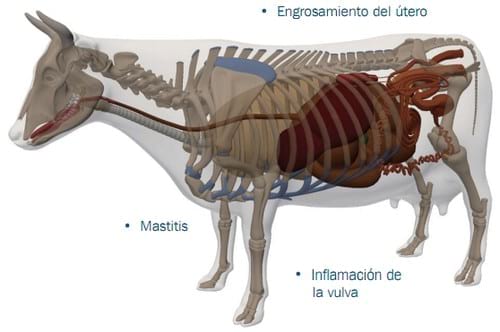
Asimismo, en determinadas áreas de África, ocasionalmente han sido hallados niveles substancialmente altos en la cerveza y las papillas preparadas a partir del maíz y sorgo contaminados. Hasta el momento, no se ha reportado ningún efecto adverso debido al consumo de zearalenona en los humanos. Sin embargo, debe prestarse mucha atención a su estudio, y considerarse como un posible peligro para la salud cuando las dosis diarias ingeridas sean tan elevadas como aquellas reportadas para los productos de fermentación africanos. Estudios realizados in vivo han revelado que la zearalenona es metabolizada rápidamente en los animales y en los humanos, y eliminada principalmente bajo la forma de compuestos glucorónicos hidrosolubles. Además, bajo condiciones experimentales han sido encontradas formas de zearalenona libres y conjugadas en la leche de las vacas lactantes. El requerimiento de una dosis oral alta de toxina para provocar tales efectos es una indicación de que el consumo de los alimentos contaminados por parte del ganado vacuno no resultará en un peligro para la salud de los humanos.
CONCLUSIONES
Sin lugar a duda las medidas preventivas para reducir la contaminación de productos agrícolas con hongos toxígenos son la mejor alternativa para evitar la presencia de las micotoxinas en nuestros alimentos. Esto puede apoyarse con el desarrollo de variedades resistentes a la contaminación por micotoxinas, el uso de prácticas agronómicas mejoradas en los cultivos (empleando densidades de población moderadas, riegos necesarios para que el cultivo no sufra por estrés de agua y fertilización nitrogenada, entre otras), así como adecuadas tecnologías poscosecha (minimizando el daño mecánico del grano durante la cosecha y realizando un secado rápido y efectivo para su transporte y almacenamiento). La seguridad en los alimentos es un aspecto que debe enfatizarse; por tanto, es necesario contar con medidas más estrictas de control por nuestras autoridades, incluso para los alimentos que se producen en nuestros países. No existe la menor duda de que las micotoxinas son causantes de enfermedades e incluso de muerte en nuestra población; sin embargo, no existen estadísticas, ni estudios precisos al respecto. Los efectos tóxicos agudos de las micotoxinas, solamente son observables en situaciones excepcionales; por tanto, no hay que olvidar que las micotoxinas también son capaces de inducir una gran variedad de enfermedades crónicas como el cáncer, resultado de una exposición a largo plazo por el consumo de alimentos contaminados, aún con bajos niveles de estas micotoxinas.
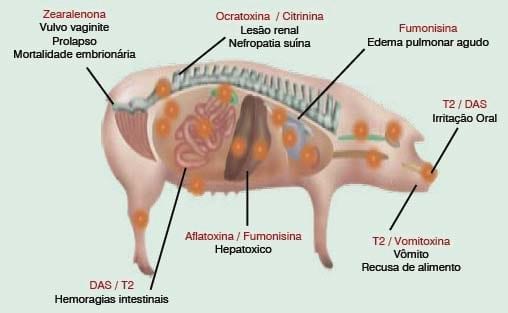
Efectos tóxicos de las principales micotoxinas y alimentos implicadosMicotoxina
Hongo productor
Efectos tóxicos
Alimentos implicados
Aflatoxinas (B1, B2, G1, G2 y M1)
Aspergillus
Hepatotóxica, inmunotóxica, teratogénica
Maíz, arroz, cacahuete, pistachos, nueces, girasol, soja, leche y productos lácteos, especias
Ocratoxinas (A)
Aspergillus
Nefrotóxica, inmunotóxica, teratogénica, mutagénica, embriotóxica, trastornos neurólogicos
Maíz, trigo, cebada, centeno, avena, arroz, uvas, zumo de uvas, vino, cerveza, café, cacao, regaliz, especias
Fumonisinas
(B1, B2)
Fusarium
Neurotóxica, inmunotóxica, nefrotóxica, hepatotóxica
Maíz, trigo, soja, cebada, cerveza
Tricotecenos (Deoxinivalenol, T2 y HT-2)
Fusarium
Necrosis cutáneas, alteraciones digestivas, hemorragias, taquicardia, inmunotóxica, hematotóxica, neurotóxica
Trigo, maíz, cebada, cerveza, centeno, avena
Zearalenona
Fusarium
Efectos estrogénicos, problemas reproductivos
Maíz, trigo, cebada, centeno, avena, cerveza
Patulina
Penicilium
Trastornos gastrointestinales, neurológicos, nefrotóxica, mutagénica
Manzana, zumos y sidra
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.