El término hiperandrogenismo se utiliza para describir el cuadro clínico resultante del exceso de andrógenos en la mujer. El diagnóstico se basa en una buena historia clínica, completada con algunas pruebas de laboratorio y pruebas de imagen.
El síndrome del ovario poliquístico es, con mucho, la etiología más frecuente de hiperandrogenismo, y una vez establecido, es preciso analizar la repercusión metabólica presente y futura, con el fin de informar y educar a la paciente sobre su impacto sobre la fertilidad y su riesgo cardiovascular. La existencia de un síndrome metabólico no debe llevar a abstenernos de una intervención terapéutica frente al hiperandrogenismo, del que no debe subestimarse el impacto psicosocial. Finalmente, este diagnóstico debe llevar también a un estudio familiar, que permite diagnosticar un síndrome del ovario poliquístico en el 50% de las hermanas de la paciente.
ETIOLOGÍA
El hiperandrogenismo puede aparecer en cualquier momento de la vida de la mujer, desde el nacimiento hasta la vejez y, de hecho, el momento de la vida en que se manifiesta junto con la velocidad de instauración y progresión de los síntomas y signos, son los factores fundamentales que nos ayudan a establecer un diagnóstico etiológico. En la tabla 1 se resume la etiología del hiperandrogenismo en relación al momento de la vida de la mujer en la que aparece.
Tabla 1.- Causas de hiperandrogenismo
Hiperandrogenismo prepuberal
· Hiperplasia suprarrenal congénita por deficiencia de 21α-hidroxilasa, 11β-hidroxilasa y 3β-hidroxiesteroide-deshidrogenasa.
· Pubarquia o adrenarquia prematura.
· Tumores productores de andrógenos (sobre todo suprarrenales).
Hiperandrogenismo en la edad fértil
· Hiperandrogenismo funcional.
Síndrome de ovario poliquístico.
Hiperandrogenismo idiopático.
Hirsutismo idiopático.
· Hiperplasia suprarrenal congénita no clásica por deficiencia de 21α-hidroxilasa (resto muy infrecuentes).
· Tumores secretores de andrógenos (excepcionales).
· Fármacos (andrógenos, glucocorticoides, anabolizantes, norgestrel, danazol, fenotiazinas, progestágenos, reserpina, testosterona, metildopa, etc.
· Otros: Síndrome de Cushing, acromegalia, la hiperprolactinemia, enfermedades tiroideas.
Hiperandrogenismo gestacional
· Luteoma
· Quiste teca-luteínico
· Fármacos: andrógenos, progestágenos, dietilestilbestrol, etc
· Deficiencia placentaria de aromatasa
· Tumores productores de andrógenos (ováricos o suprarrenales)
Hiperandrogenismo postmenopáusico
· Disbalance fisiológico entre estrógenos/andrógenos.
· Persistencia de hiperandrogenismo funcional previo.
· Tumores productores de andrógenos (sobre todo ováricos).
· Fármacos.
· Otros: síndrome de Cushing, acromegalia, la hiperprolactinemia, enfermedades tiroideas.
Hiperandrogenismo prepuberal
La causa más frecuente de hiperandrogenismo en la etapa prepuberal es la hiperplasia suprarrenal congénita, trastorno genético autosómico recesivo, relativamente frecuente, debido a la deficiencias de 21α-hidroxilasa, 11β-hidroxilasa y 3 β-hidroxiesteroide-deshidrogenasa.
Los casos de deficiencia enzimática grave, denominados “clásicos” se manifiestan en el nacimiento por insuficiencia suprarrenal primaria y un grado variable de virilización de los genitales externos, asociado a hipertensión sólo en el caso de la deficiencia de 11β-hidroxilasa (por secreción exagerada de 11-desoxicorticosterona)
Cuando el exceso androgénico se manifiesta a partir de los 6 años de edad, la hiperplasia suprarrenal se denomina “no clásica”, causada, en general, por deficiencias enzimáticas leves, generalmente de 21α-hidroxilasa.
Después de la hiperplasia suprarrenal congénita, en este grupo de edad, la causa más frecuente es la pubarquia o adrenarquia prematura. Esta se caracteriza por la aparición en niñas de vello terminal axilar o pubiano antes de los 8 años de edad en ausencia de cualquier otro síntoma o signo de desarrollo puberal. El perfil hormonal (androgenos, gonadotrofinas) de estas niñas puede ser normal (denominándose pubarquia prematura) o mostrar unas concentraciones discretamente elevadas de sulfato de dehidroepiandrosterona (DHEAS), sugiriendo hiperactividad suprarrenal (denominándose adrenarquia prematura). En los últimos años se han acumulado evidencias sugerentes de que la adrenarquia prematura puede ser la primera manifestación del hiperandrogenismo funcional en aproximadamente la mitad de las niñas, las cuales desarrollan síndrome de ovario poliquístico tras la pubertad. En este subgrupo existe evidencia de resistencia insulínica y adiposidad visceral abdominal desde antes de la pubertad.
Los tumores secretores de andrógenos (suprarrenales y en menor medida ováricos) son muy poco frecuentes en esta etapa.
Hiperandrogenismo en la edad fértil
Este grupo de edad recoge la mayoría de casos de hiperandrogenismo. Los cuadros más frecuentes son el síndrome de ovario poliquístico, el hiperandrogenismo idiopático y el hirsutismo idiopático, que se engloban en lo que se conoce como hiperandrogenismo funcional. Menos frecuentemente, la aparición peripuberal de síntomas hiperandrogénicos desenmascara una hiperplasia suprarrenal congénita no clásica por deficiencia de 21α-hidroxilasa u 11β-hidroxilasa. Afortunadamente, los tumores secretores de andrógenos son muy infrecuentes en este rango de edad, como también infrecuentes los casos yatrogénicos por administración de fármacos con actividad androgénica.
El síndrome del ovario poliquístico es, con mucho, la etiología más frecuente, y una vez establecido el diagnóstico es preciso analizar la repercusión metabólica actual y futura, con el fin de informar y educar a la paciente sobre su impacto sobre la fertilidad y su riesgo cardiovascular. La existencia de un síndrome metabólico no debe llevar a abstenernos de una intervención terapéutica frente al hiperandrogenismo, del que no debe subestimarse el impacto psicosocial. Finalmente, este diagnóstico debe llevar también a un estudio familiar, que permite diagnosticar un síndrome del ovario poliquístico en el 50% de las hermanas de la paciente.
Hiperandrogenismo gestacional
El hiperandrogenismo gestacional es muy infrecuente. Las causas más frecuentes son los luteomas y los quistes teca-luteínicos que revierten tras la gestación, por lo que no requieren tratamiento específico.
Los luteomas no son tumores, sino grandes masas de células luteínicas hiperplásicas, frecuentemente bilaterales, que crecen por el estímulo de la gonadotrofina coriónica y pueden producir grandes cantidades de andrógenos. Sin embargo, como las concentraciones circulantes de globulina transportadora de hormonas sexuales (SHBG) son muy elevadas durante la gestación las concentraciones de testosterona libre son relativamente normales, y los síntomas hiperandrogénicos sólo aparecen en el 30-35% de los casos. Ocasionan virilización en el 80% de los fetos femeninos
Los quistes teca-luteínicos también parecen ser resultado del efecto de la gonadotrofina coriónica, y son especialmente prevalentes en mujeres con antecedentes de enfermedad trofoblástica, sobre todo si padecen Síndrome del Ovario Poliquístico. Sólo causan virilización en el 30% de las madres y no se asocian a virilización fetal.
Hiperandrogenismo tras la menopausia
La mayoría de los casos son cuadros de hiperandrogenismo funcional, ya presentes antes de la menopausia, y que, como consecuencia del disbalance entre la secreción de estrógenos y la de andrógenos que ocurre tras la menopausia, pueden empeorar moderadamente, llevando a la paciente a consultar en ese momento. Sin embargo, lo más habitual es que los síntomas hiperandrogénicos en mujeres hiperandrogénicas mejoren conforme se acerca la menopausia y tras la misma, por lo que la aparición verdadera de signos de hiperandrogenismo, y muy especialmente si se acompañan de virilización, obliga a descartar un tumor productor de andrógenos, particularmente tumores de células de Sertoli-Leydig, tumores de células estromales y tumores o hiperplasias de células tecales o hiliares del ovario.
MANIFESTACIONES CLÍNICAS
El hiperandrogenismo puede ser secundario a una hiperproducción de andrógenos a nivel del ovario o de gandulas suprarrenales. Sin embargo, su expresión clínica está condicionada por la concentración de globulina transportadora de hormonas sexuales (SHBG), por la conversión periférica (5-alfa-reductasa) y por el nivel de receptores de los andrógenos. Todos estos parámetros están influidos por factores étnicos, genéticos y personales. La unidad pilosebácea reacciona, por tanto, frente al hiperandrogenismo de forma muy variable. Hay que destacar que la intensidad y la velocidad de aparición de los signos clínicos de hiperandrogenismo son primordiales y permiten diferenciar las etiologías graves de las benignas.
Hirsutismo
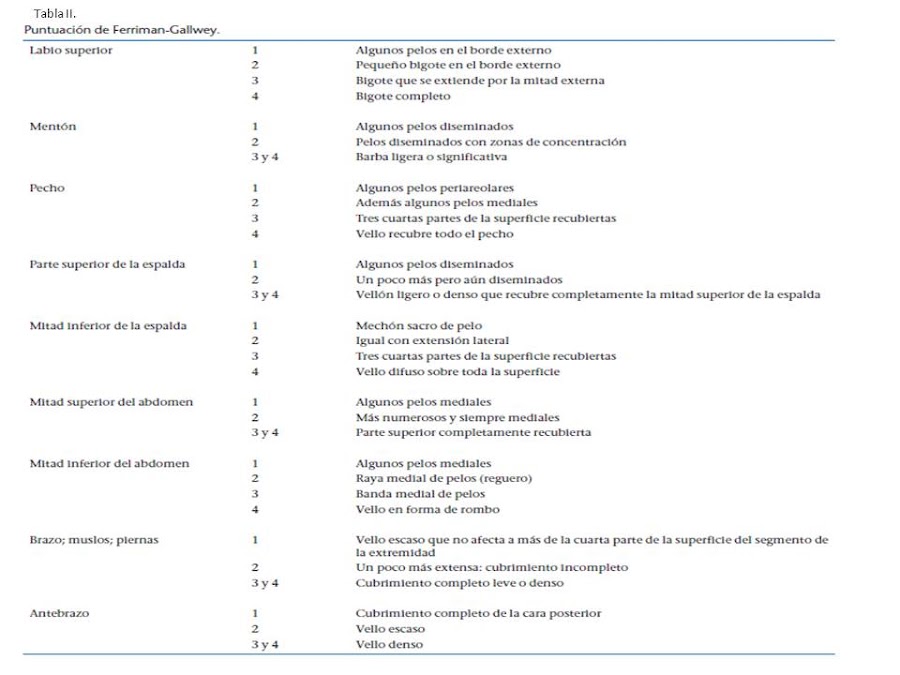
Consiste en la aparición de pelos duros y pigmentados en territorios masculinos (cara, tórax, espalda, línea alba, huecos inguinales, caras internas y posteriores de los muslos). Se evalúa mediante la puntuación de Ferriman y Gallwey (Tabla II), cuyo límite patológico es una puntuación mayor de 6 puntos. Es preciso diferenciarlo de la hipertricosis, no dependiente de andrógenos, y que corresponde a la simple exageración de la distribución femenina normal del pelo.
Acné y seborrea
El acné es una afectación hormonodependiente del folículo pilosebáceo de tipo retentivo, por aumento de la producción de sebo e hiperqueratosis del conducto excretor, y/o de tipo inflamatorio, por colonización bacteriana. El acne del hiperandrogenismo es habitualmente inflamatorio y grave, de topografía masculina (mentón, cuello, tórax) y a menudo de aparición precoz, antes incluso del desarrollo puberal.
Alopecia
Excepcional en la adolescencia, la alopecia de la coronilla es también un signo de hiperandrogenismo que puede variar desde el aspecto ralo en la coronilla hasta la existencia de calvicie con esbozo de entradas frontales, que constituye un signo mayor de virilización. También en este caso, la alopecia aislada no es siempre el signo de un hiperandrogenismo y puede poner de manifiesto otras causas como las carencias de hierro, los problemas psicológicos o las causas autoinmunitarias.
Alteraciones menstruales
Lo más frecuente es que se trate de una espanomenorrea (aumento del intervalo entre dos reglas o disminución del flujo hemorrágico) que, no obstante, puede considerarse como fisiológica durante los dos años posteriores a la menarquia. Otras manifestaciones son amenorrea o, de modo más infrecuente, metrorragias.
Signos de virilización
El hiperandrogenismo de etiología tumoral suele ser de expresión más rápida y más grave con signos mayores de virilización: Apariencia masculina e hipertrofia muscular; voz grave; hipertrofia clitorídea y de los labios mayores.
Signos de desfeminización
Atrofia mamaria y pérdida de la grasa en cintura pélvica.
EXPLORACIONES DE LABORATORIO
Los tres principales andrógenos que es necesario determinar son:
• Testosterona plasmática, reflejo de la producción ovárica, suprarrenal o mixta.
• Sulfato de deshidroepiandrosterona (DHEAS), reflejo exclusivamente suprarrenal.
• 17-hidroxiprogesterona (17-OHP) plasmática, marcador del déficit de 21-hidroxilasa.
Testosterona
No hay unas normas universalmente aceptadas en cuanto a cómo se debe realizar su determinación. Dada su secreción pulsátil y la variación de los niveles durante los ciclos menstruales, es conveniente obtener varias muestras el mismo día y realizarlas siempre durante los primeros días del ciclo. Asimismo, siempre que sea posible, tiene más valor la determinación testosterona total y globulina transportadora de hormonas sexuales (SHBG), con las cuales calcularemos el marcador de hiperandrogenismo más sensible, el índice de testosterona libre, ya que la testosterona total está condicionada por los valores de la SHBG. No se aconseja la medición de testosterona libre por radioinmunoanálisis (RIA) ya que este método es más inexacto.
Sulfato de deshidroepiandrosterona (DHEAS)
La determinación de DHEA-S es un buen indicador de la producción androgénica suprarrenal; cuando sus valores son tres o cuatro veces el valor normal hay que sospechar un tumor suprarrenal.
17-hidroxiprogesterona (17-OHP)
La determinación plasmática de 17-OH-progesterona es un marcador del déficit de 21-hidroxilasa, de forma que niveles superiores a 9 nmol/l son sugerentes de hiperplasia adrenal de inicio tardío
Otras exploraciones
El resto de las exploraciones complementarias se elegirán en función de la sospecha diagnóstica:
Prueba de estimulación on ACTH: Una determinación de 17-hidroxiprogesterona inferior a 1,7 ng/ml descarta déficit de 21-hidroxilasa esta enfermedad con una seguridad diagnóstica del 98%. En mujeres con valores superiores se debe realizar una prueba de estímulo con ACTH,administrando 250 μg de corticotrofina sintética en bolo intravenoso, descartandose el déficit de esta enzima si el pico a los 30 minutos es inferior a 10 ng/ml.
Prolactina: La hiperprolactinemia no es una causa de hiperandrogenismo, pero hay que descartarla como causa de oligo-ovulación. Debe determinarse si existe galactorrea o alteraciones del ciclo menstrual.
Cortisol libre urinario: El síndrome de Cushing debe sospecharse por la exploración física, debiendo determinarse cortisol libre urinario cuando existe sospecha clínica de hipercorticismo. Una concentración superior a 300 μg día es casi patognomónica. Si los valores se encuentra entre 60-300 μg día, la prueba de frenado rápido (determinación del cortisol plasmático a las 8 h de la mañana, habiendo ingerido la paciente 1 mg de dexametasona la víspera a medianoche) es indispensable. Una concentración que se mantenga por encima de 3 μg 100 ml debe llevar a otras estudios como ciclo nictameral del cortisol y de la ACTH, prueba de frenado «fuerte» con dexametasona, prueba de la metopirona, prueba de la hormona liberadora de corticotropina (CRF), tomografía computarizada o resonancia magnética suprarrenal y/o hipofisaria.
TSH: La disfunción tiroidea se descarta mediante determinación de hormona tirotrofa (TSH)
FSH y LH: La menopausia precoz se descarta midiendo la hormona foliculoestimulante (FSH). La determinación de hormona luteinizante (LH) o de su cociente con FSH aporta poco al diagnóstico.
GH y/o IGF1: A menudo se cita el hirsutismo entre las manifestaciones cutáneas de la acromegalia, aunque raramente constituye el motivo inicial de consulta. El exceso de GH y/o de IGF1 y el hiperinsulinismo debidos a la acromegalia podrían constituir en teoría causas favorecedoras de la génesis de hirsutismo y de síndrome de ovario poliquístico. Es preciso tener presente esta posible situación ya que los síntomas de acromegalia son a menudo poco claros en la adolescente.
Sobrecarga oral de glucosa (75 g) e insulinemia: Obligada si hay obesidad, con ella detectaremos trastornos de la tolerancia a los hidratos de carbono y estimaremos la sensibilidad a la insulina. Resulta poco practico realizar marcadores sofisticados del hiperinsulinismo y/o de la insulinorresistencia, salvo en un contexto familiar de insulinorresistencia.
Perfil lipídico con fracciones de colesterol y triglicéridos: Debe incluirse también en el protocolo diagnóstico.
En al tabla III se resume el diagnóstico diferencial del hiperandrogenismo basado en los resultados de las pruebas de laboratorio.
PRUEBAS DE IMAGEN
EcografíaLa ecografía es el examen de referencia para el diagnostico del síndrome del ovario poliquístico. Sin embargo, en la adolescente, lo más frecuente es que sólo sea posible la vía suprapúbica, lo que hace más difícil la valoración de los criterios diagnósticos del síndrome del ovario poliquistico, definidos para la vía endovaginal. Estos criterios, denominados «de Rotterdam», son:
Aumento del volumen ovárico (volumen por ovario superior a 10 cm3)
Ecoestructura que contenga más de 12 imágenes anecoicas (folículos) de 2-9 mm por ovario.
Este último criterio es muy difícil de obtener por vía suprapúbica: en caso de una adolescente, es preciso por tanto dar preferencia al primero. Es posible también ayudarse de criterios secundarios como la hipertrofia estromal hiperecogénica, la forma globulosa de los ovarios (relación longitud/anchura superior a 0,7) o una relación fondo uterino/eje ovárico mayor inferior a 1; sin embargo, estos criterios tienen una sensibilidad y/o especificidad mas bajas.
TAC/RM de ovarios o suprarrenales
La progresión rápida de los signos de hiperandrogenismo, y sobre todo el inicio brusco fuera del periodo peripuberal, nos obliga a descartar la presencia de un tumor secretor de andrógenos mediante técnicas de imagen como TAC y/o RM , sin esperar a disponer de concentraciones circulantes de andrógenos ni otras pruebas complementarias.
TRATAMIENTO
Tratamiento quirúrgico
El tratamiento de los tumores ováricos o suprarrenales será siempre quirúrgico mediante laparoscopia o laparotomía. En función de los criterios de malignidad anatomopatológicos se impone muy a menudo un tratamiento complementario de los tumores suprarrenales, a base de mitotano o diclorodifenildicloroetano.
Corticoides
El tratamiento del déficit de 21-hidroxilasa con corticoides a largo plazo está en discusión actualmente. Para algunos autores, sólo es necesaria en caso de hiperplasia suprarrenal constatada en la tomografía computarizada y/o si se desea un embarazo. En este caso, se prescriben pequeñas dosis de dexametasona en toma vespertina (0,25-0,5 mg/día) o Prednisona (5-7,5 mg/día).
Antiandrógenos
Acetato de ciproterona y drospirenona: Se trata de progestágenos dotados de efectos antigonadótropos (frenan la secreción hipofisaria de LH y FSH, lo que provoca la inhibición completa de la función ovárica) y antiandrogénicos (sus efectos son dobles: por una parte, inhibición de la unión de la dihidrotestosterona (DHT) a su receptor y, por otra parte frenado de la acción de enzimas suprarrenales implicados en la esteroidogénesis). El esquema clásico de administración consiste en la asociación de la ciproterona acetato (50 mg día) o drospirenona (30 mg dia) a un estrógeno natural (17-b-estradiol) en comprimidos que se administran durante 21 días al mes.
Espironolactona: Su estructura es parecida a la de la progesterona. Se une a los receptores mineralcorticoides, pero también a los receptores de la progesterona y de los andrógenos, produciendo disminución de la biosíntesis de testosterona por inhibición del citocromo P450 y, por otra parte, inhibe la unión de la DHT a los receptores de los andrógenos. . No posee efecto antigonadótropo. Se utiliza en dosis de 50-100 mg/12 h, y no altera la TA en pacientes normotensas. Su utilización como único tratamiento puede originar sangrados uterinos; por esta razón se emplea asociada a anticonceptivos orales.
Finasterida: La finasterida en dosis de 5 mg/día, por su acción inhibitoria de la 5-a-reductasa, también se ha mostrado eficaz.
Flutamida: Tiene una eficacia similar a las anteriores, pero puede originar hepatitis, en ocasiones con desenlace fatal, lo que obliga a utilizarla con precaución.
Todos los antiandrógenos están contraindicados durante la gestación y por esta razón debe asegurarse la anticoncepción durante el tratamiento con los mismos.
Tratamientos cosméticos
El tratamiento farmacológico del hiperandrogenismo, independientemente de su causa, debe acompañarse de un tratamiento cosmético, mediante técnicas de decoloración o depilación mediante métodos de arrancamiento físico o químico. La depilación eléctrica o con láser permite eliminar de modo definitivo el folículo pilosebáceo. Debe reservarse para las zonas más comprometidas desde el punto de vista estético (cara, pezón, línea puboumbilical).
Existe un nuevo producto, la eflornitina, que constituye el primer producto tópico que retarda el crecimiento del pelo. Su mecanismo de acción se basa en que algunas proteínas denominadas poliaminas son necesarias para el crecimiento y la diferenciación de las células del folículo piloso, dependiendo la producción de estas poliaminas de la actividad de un enzima, la ornitina descarboxilasa, que es bloqueada por la eflornitina.
Tratamiento del síndrome del ovario poliquistico
El principal interés del diagnóstico precoz del síndrome del ovario poliquistico consiste en sensibilizar a las pacientes respecto a sus complicaciones metabólicas y proporcionarles educación sanitaria. Ello comporta un abordaje global dirigido a corregir los demás factores de riesgo cardiovascular como el tabaco, aconsejar una actividad física regular, alcanzar y mantener un peso ideal gracias a una dieta equilibrada. Ademas de los anticonceptivos orales con acción antiandroegencia, diversos estudios han mostrado la eficacia de la metformina sobre la tolerancia a la glucosa y, también, sobre el hiperandrogenismo, siendo de primera elección cuando cuando el síndrome metabólico está en primer plano y es resistente a las medidas higienicodietéticas.
BIBLIOGRAFÍA RECOMENDADA
Álvarez-Blasco F, Botella-Carretero JI, San Millan JL, Escobar-Morreale HF. Prevalence and characteristics of the polycystic ovary syndrome in overweight and obese women. Arch Intern Med. 2006;166(19):2081-6.
Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar- Morreale HF, Futterweit W, et al. Position statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006;91(11):4237-45.
Azziz R, Dewailly D. Diagnosis, screening, and treatment of nonclassic 21-hydroxylase deficiency. In:Azziz R, Nestler JE, Dewailly D, editors. Androgen excess disorders in women. Philadelphia: Raven Press-Lippincott; 1997. p. 181-92.
Balen AH, Laven JS, Tan SL, Dewailly D. Ultrasound assessment of the polycystic ovary: international consensus definitions. Hum Reprod Update 2003;9:505-14.
Caron PH, Cogne M, Rumeau JL, Hoff J. Androgenic granulosa cell tumor of the ovary: in vivo hormonal studies. J Endocrinol Invest 1993;16:545-8.
Codner E, Escobar-Morreale HF. Clinical review: Hyperandrogenism and polycystic ovary syndrome in women with type 1 diabetes mellitus. J Clin Endocrinol Metab. 2007;92(4):1209-16.
Center for Young Womens Health. "Polycystic Ovary Syndrome (PCOS): A Guide for Teens." http://www.youngwomenshealth.org/pcos_resource_book.html
Cortet-Rudelli C, Desailloud R, Dewailly D. Drug-induced androgen excess. In:Azziz R, Nestler JE, Dewailly D, editors. Androgen excess disorders in women. Philadelphia: Raven Press-Lippincott; 1997. p. 613-24.
Dewailly D, Cortet-Rudelli C, Decanter C. Pathophysiology and clinical manifestations of nonclassic 21-hydroxylase deficiency. In: Azziz R, Nestler JE, Dewailly D, editors. Androgen excess disorders in women. Philadelphia: Raven Press-Lippincott; 1997. p. 173-80.
Dunaif A. Insulin resistance and the polycystic ovarian syndrome: mechanism and implications for pathogenesis. Endocr Rev 1997;18:774-800.
Escobar-Morreale HF, Carmina E, Dewailly D, Gambineri A, Kelestimur F, Moghetti P, et al. Epidemiology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2012;18(2):146-70.
Escobar-Morreale HF, Luque-Ramírez M, San Millan JL. Themolecular-genetic basis of functional hyperandrogenism and the polycystic ovary syndrome. Endocr Rev. 2005;26:251-82.
Escobar-Morreale HF, San Millan JL. Abdominal adiposity and the polycystic ovary syndrome. Trends Endocrinol Metab. 2007; 18(7):266-72.
Escobar-Morreale HF, Sanchon R, San Millan JL. A prospective study of the prevalence of nonclassical congenital adrenal hyperplasia among women presenting with hyperandrogenic symptoms and signs. J Clin Endocrinol Metab. 2008;93(2):527-33.
Forest MG, MorelY. Formes non classiques dites « tardives » du déficit en 21-hydroxylase : diagnostic différentiel avec les hétérozygotes et conseil génétique. Rev Fr Endocrinol Clin 1992;33:47-61.
Goodman NF, Bledsoe MB, Cobin RH, et al. American Association of Clinical Endocrinologists medical guidelines for the clinical practice for the diagnosis and treatment of hyperandrogenic disorders. Endocr Pract 2001; 7:120.
Hatch R, Rosenfield RL, Kim MH, Tredway D. Hirsutism: implications, etiology, and management. Am J Obstet Gynecol. 1981;140(7):815-30.
Ibanez L, Dimartino-Nardi J, Potau N, Saenger P. Premature adrenarche: normal variant or forerunner of adult disease? Endocr Rev 2000;21:671-96.
Ibanez L, Valls C, Cabre S, De Zegher F. Flutamidemetformin plus ethinylestradiol-drospirenone for lipolysis and antiatherogenesis in young women with ovarian hyperandrogenism: the key role of early, low-dose flutamide. J Clin Endocrinol Metab 2004;89:4716-20.
Korytkowski MY, Mokan M, Horwitz MJ, Berga SL. Metabolic effects of oral contraceptives in women with polycystic ovary syndrome. J Clin Endocrinol Metab 1995;80:3327-34.
Legro RS, Barnhart HX, Schlaff WD, Carr BR, Diamond MP, Carson SA, et al. Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med. 2007;356(6):551-66.
Lobo RA. Ovarian hyperandrogenism and androgen producing tumors. Endocrinol Metab Clin NorthAm1991;20: 773-805.
Luque-Ramírez M, Álvarez-Blasco F, Botella-Carretero JI, Martínez-Bermejo E, Lasuncion MA, Escobar-Morreale HF. Comparison of ethinyl-estradiol plus cyproterone acetate versus metformin effects on classic metabolic cardiovascular risk factors in women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 2007;92(7):2453-61.
Luque-Ramírez M, Álvarez-Blasco F, Mendieta-Azcona C, Botella-Carretero JI, Escobar-Morreale HF. Obesity is the major determinant of the abnormalities in blood pressure found in young women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 2007;92(6):2141-8.
Luque-Ramírez M, Mendieta-Azcona C, Álvarez-Blasco F, Escobar-Morreale HF. Androgen excess is associated with the increased carotid intima-media thickness observed in young women with polycystic ovary syndrome. Hum Reprod. 2007;22(12):3197-203.
Sanchon R, Gambineri A, Alpanes M, Martínez-Garcia MA, Pasquali R, Escobar-Morreale HF. Prevalence of functional disorders of androgen excess in unselected premenopausal women: a study in blood donors. Hum Reprod. 2012;27(4):1209-16.
Spritzer P, Billaud L, Thalabard JC, Birman P, Mowszowicz I, Raux-Demay MC, et al. Cyproterone acetate versus hydrocortisone treatment in late-onset adrenal hyperplasia. J Clin Endocrinol Metab 1990;70:642-6.
The Rotterdam ESHRE/ASRM sponsored PCOS consensus workshop group. Hum Reprod 2004;19:41-7.
van Hooff MH, Voorhorst FJ, Kaptein MB, Hirasing RA, Koppenaal C, Schoemaker J. Predictive value of menstrual cycle pattern, body mass index, hormone levels and polycystic ovaries at age 15 years for oligo-amenorrhoea at age 18 years. Hum Reprod 2004;19:383-92.
Wild RA, Carmina E, Diamanti-Kandarakis E, Dokras A, Escobar-Morreale HF, Futterweit W, et al. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab. 2010; 95(5):2038-49.
Young RH, Scully RE. Ovarian Sertoli-Leydig cell tumors: a clinicopathological analysis of 207 cases. Am J Surg Pathol 1985;9:543-69.