(Cocó Channel)
ENFERMEDADES TRANSMITIDAS POR ALIMENTOS (Parte 13)
Tricuriasis, Trichuriasis, Tricocefaliasis o Tricocefaliosis (CIE-10 b79)
Es una geohelmintosis cosmopolita que predomina en las áreas cálidas y húmedas. Trichuris trichiura o Trichocephalus trichiurus, es un nematodo con morfología inconfundible de “lombriz látigo” por su parte anterior filiforme y la posterior más corta y gruesa. Tiene distribución mundial, siendo el número estimado de personas parasitadas de 500 millones con 10.000 casos clínicos anuales. Es de reservorio humano exclusivo. El portador puede serlo por años si no recibe tratamiento. La prevalencia está relacionada con la humedad del suelo; en Argentina, la proporción de Trichuris trichiura en los estudios coproparasitológicos fue del 0,2 % en Mendoza y entre el 4-12,5 % en el Gran La Plata. Los niños son los que más se infectan en las zonas endémicas y contaminan el domicilio y el peri domicilio por sus hábitos higiénicos. Los huevos expulsados en las heces tienen una gruesa capa gris amarillenta con dos polos de tapón albuminoso que le dan el aspecto de un limón. Desarrollan los embriones en la tierra húmeda y cálida o en el agua en alrededor de 7-14 días. Pueden permanecer vivos por períodos de hasta 5 años.
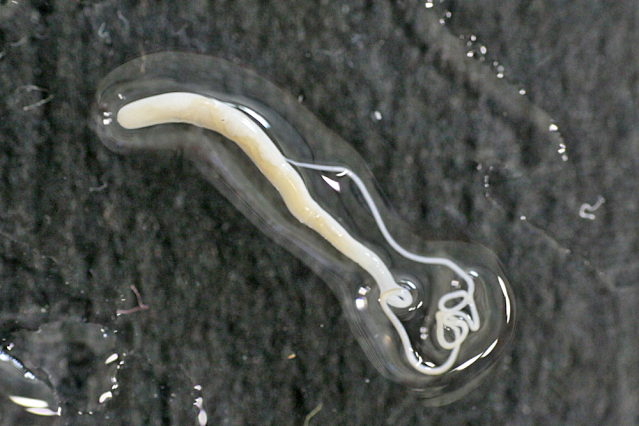
Se transmite por vía digestiva por el hábito de pica o geofagia (comer tierra) y a través de verduras contaminadas. El agente etiológico se localiza en el colon, en donde causa patología de intensidad variable, de acuerdo al número de parásitos y a las condiciones del huésped. Trichuris trichiura o tricocéfalo, deriva su nombre del término "trico" que significa pelo. Es un gusano blanco de aproximadamente 3 a 5 cm de largo. La parte anterior que es delgada, ocupa dos terceras partes del parásito. El tercio posterior es más grueso y en conjunto simula un látigo. La hembra termina en forma recta en su extremo posterior mientras que el macho tiene una curvatura pronunciada y está provisto en este extremo de una espícula copulatriz. Cerca de este órgano se encuentra la cloaca donde desemboca el aparato genital masculino. Los machos, como en casi todos los helmintos, son más pequeños que las hembras. El tubo digestivo se inicia con la boca que es pequeña y provista de una lanceta diminuta, continúa con el esófago formado por un tubo rodeado de glándulas unicelulares en forma de cadena y le sigue el intestino que termina en el ano cerca del extremo posterior.
El esófago está en la parte delgada del parásito, mientras que el intestino y los órganos genitales ocupan la parte gruesa del parásito. El aparato genital es muy desarrollado, principalmente en las hembras; el útero termina en una vagina corta que desemboca en un orificio vulvar situado cerca de la unión de la parte delgada con la gruesa. Los huevos son muy característicos y fáciles de identificar, miden aproximadamente 25 micras de ancho por 50 de largo, de color café, membrana doble y tapones en los extremos. Se ingieren los huevos embrionados con el agua o verduras crudas. Los embriones son liberados en el intestino y se convierten en larvas que inicialmente se adhieren a las vellosidades del intestino delgado. En aproximadamente un mes se produce la maduración del parásito a la forma adulta y migra para localizarse con su extremidad anterior en la mucosa (raramente en la submucosa y en la capa muscular) del ciego y el apéndice y con menor frecuencia en colon e íleon. La hembra es fecundada y a los 70-90 días comienza la eliminación de los huevos embrionados (2.000 a 14.000/día/hembra). Cuando la infección es severa se produce diarrea sanguinolenta, dolor abdominal, pujo, tenesmo y prolapso rectal.
Los gusanos macho y hembra se enclavan por su parte delgada en la mucosa del intestino grueso, órgano en el que producen la patología. Esta penetración la hacen ayudados por una lanceta retráctil, que le permite profundizar hasta quedar fuertemente enclavados. Después de copular, la hembra produce huevos fértiles que salen con las materias fecales para reanudar el ciclo. Se calcula que después de ingerir huevos embrionados se tienen parásitos adultos con capacidad de producir huevos, en un período de 2 a 3 meses. Cada hembra produce entre 3.000 y 20.000 huevos por día. La principal patología producida por los tricocéfalos proviene de la lesión mecánica, al introducirse parte de la porción anterior en la mucosa del intestino grueso. Es, pues, una lesión traumática que causa inflamación local, edema y hemorragia, con pocos cambios histológicos. La gravedad de la patología es proporcional al número de parásitos. En casos graves existe una verdadera colitis y cuando hay intensa invasión del recto, asociada a desnutrición, puede presentarse el prolapso de la mucosa rectal.
La pérdida de sangre, que ocurre en los casos de infecciones severas, se debe a hemorragia causada por la colitis disentérica y el prolapso rectal, además de la posible ingestión de eritrocitos por el parásito, dentro de su alimentación normal. Aunque el tema de la ingestión de sangre por estos parásitos ha sido controvertido, se acepta que realmente no son hematófagos. Enfermedades concomitantes que causan colitis o rectitis, como la amebiasis, agravan las lesiones de la tricocefalosis. Las ulceraciones producidas en amebiasis o en otras enfermedades, pueden confluir con las lesiones que causan los tricocéfalos y aumentar, de esta manera, la patología de la enfermedad. Ocasionalmente los parásitos pueden introducirse en el apéndice y causar inflamación de este órgano. Las infecciones leves, especialmente en adultos con buen estado de salud, no originan síntomas y se diagnostican por el hallazgo ocasional de huevos al examen coprológico.
Las infecciones de intensidad media producen dolor de tipo cólico y diarrea ocasionales. Al palpar la fosa ilíaca derecha, puede encontrarse sensibilidad. La sintomatología franca se encuentra en casos de parasitismo intenso y es especialmente grave en niños desnutridos. La parasitosis de por sí contribuye a la desnutrición. El cuadro clínico se caracteriza por disentería, similar a la amebiana o de otras etiologías. Los síntomas principales son: dolor cólico, diarrea con moco y sangre, pujo y tenesmo. La tricocefalosis intensa en niños desnutridos, que sufren el parasitismo en forma crónica, causa enflaquecimiento, anemia y falta de desarrollo en la estatura. Recientes estudios en niños con estas características, tratados adecuadamente para esta parasitosis, han revelado que recuperan las características físicas, incluyendo la normalidad en la estatura. Se ha descrito la presencia de dedos en palillo de tambor en niños con tricocefalosis crónica intensa.
El diagnóstico clínico es imposible de hacer en las formas leves y medianas. En los casos intensos con cuadro disentérico, debe hacerse un diagnóstico diferencial con amibiasis, balantidiosis, disentería bacilar, colitis ulcerativa, etc. Cuando se presenta el prolapso a causa de esta enfermedad se observan, con frecuencia, los parásitos enclavados en la mucosa. La confirmación del diagnóstico debe hacerse por la identificación de los huevos en las materias fecales. Es importante correlacionar el número de éstos con la intensidad de la infección, para lo cual se utilizan los métodos de recuento de huevos. Se considera de manera aproximada que infecciones con menos de 5.000 h.p.g. son leves. Cifras entre 5.000 y 10.000 h.p.g. constituyen infecciones de intensidad media y las que presentan más de 10.000 h.p.g. pueden considerarse intensas. Algunos estudios han demostrado que realmente deben considerarse intensas aquellas por encima de 30.000 h.p.g. Es posible calcular aproximadamente el número de parásitos adultos existentes en el intestino, con base en los recuentos de huevos, dividiendo por 200 la cifra de h.p.g. De esta manera una infección asintomática con un recuento de 1.000 h.p.g. equivale a 5 parásitos en el colon.
En adultos y niños bien nutridos pueden existir recuentos más altos sin que haya sintomatología. La rectosigmoidoscopia permite observar los parásitos localizados en la mucosa. Es indispensable que el médico y el laboratorista sepan identificar los parásitos adultos, para poder hacer un diagnóstico correcto, cuando son llevados por el paciente o extraídos en la rectosigmoidoscopia. Las infecciones leves sin manifestaciones clínicas no requieren estrictamente tratamiento. Las infecciones medianas y severas deben tratarse siempre. Las siguientes drogas se recomiendan en la actualidad:
Benzimidazoles: El más antiguo de ellos, Mebendazol, se usa a la dosis de 100 mg, dos veces al día por 3 días para todas las edades. El albendazol a la dosis de 400 mg por día, durante 3 días y el flubendazol de 300 mg por día por 2 días. Las dosis únicas de estos benzimidazoles son menos efectivas en tricocefalosis que. en ascariosis y uncinariosis. El mejor de ellos a dosis única de 500 mg es mebendazol, que produce curación en sólo 14%, pero reducción de huevos en 82%.
El albendazol a la dosis única de 400 mg produce 10% y 73% de curación y reducción de huevos. Estos antihelmínticos actúan en forma lenta y los parásitos muertos por el medicamento se demoran hasta 4 días para eliminarse. Aunque los benzimidazoles son teratogénicos experimentalmente, no se conoce este efecto en humanos tratados con dosis terapéuticas. Los productores, sin embargo, recomiendan no usarlas en embarazadas ni en menores de 1 año.
Pamoato de oxantel: Es una droga que existe en forma comercial en algunos países. Químicamente es análogo al pirantel, pero en su efecto terapéutico se diferencia de éste porque no es efectivo contra Ascaris. En algunos países se presentan combinaciones de oxantel y pirantel con el fin de tener un mayor espectro antihelmíntico. El oxantel es un compuesto cristalino, amarillo, prácticamente insoluble en agua, con mínima absorción por el intestino, bien tolerado y sin toxicidad a dosis terapéuticas. La dosis recomendada es 10 mg/kg, 2 veces al día, durante 3 días. En infecciones leves son suficientes 10 mg/kg, como dosis única.
El tratamiento inmediato del prolapso rectal consiste en la reducción manual de la mucosa prolapsada, previa extracción de los parásitos visibles, utilizando técnicas asépticas para esta maniobra. Después de este procedimiento es recomendable mantener los glúteos ajustados sobre el ano, utilizando bandas de esparadrapo o material similar, sin impedir que el paciente pueda tener defecaciones sin dificultad. El tratamiento de fondo para el prolapso es la corrección del estado nutricional y la curación de la parasitosis. Si existe anemia u otras parasitosis asociadas se debe recurrir al tratamiento adecuado. Como métodos auxiliares del diagnóstico, se describen el hallazgo de los huevos en las heces con recolección seriada en formol al 5-10%. Para la concentración de los huevos se recomienda el método de flotación de Fulleborn y para evaluar la infección, el frotis grueso cuantitativo de Kato, el método de Stoll o el método de dilución de Stoll modificado.
· Provisión de agua segura.
· Eliminación sanitaria de las excretas.
· Educación sanitaria en los aspectos referidos al lavado de manos.
· Evitar la ingestión de tierra.
· Lavado cuidadoso de las verduras.
· El control de curación postratamiento debe realizarse a los 30 y 60 días. En las zonas endémicas se recomienda el estudio parasitológico una o dos veces por año.
La epidemiología de la tricocefalosis es muy similar a la de ascariosis, pues es también una geohelmintosis adquirida por vía oral. Las condiciones ambientales como temperatura y humedad adecuadas, así como los factores relacionados con el huésped, siguen las mismas características ya descritas en la epidemiología de la ascariosis, aunque hay menor frecuencia de tricocefalosis en las regiones tropicales áridas. Debe anotarse que los huevos de Trichuris son más sensibles a la desecación que los de Áscaris.
Toxocariosis o Toxocariasis (CIE 10 - b 83.0)
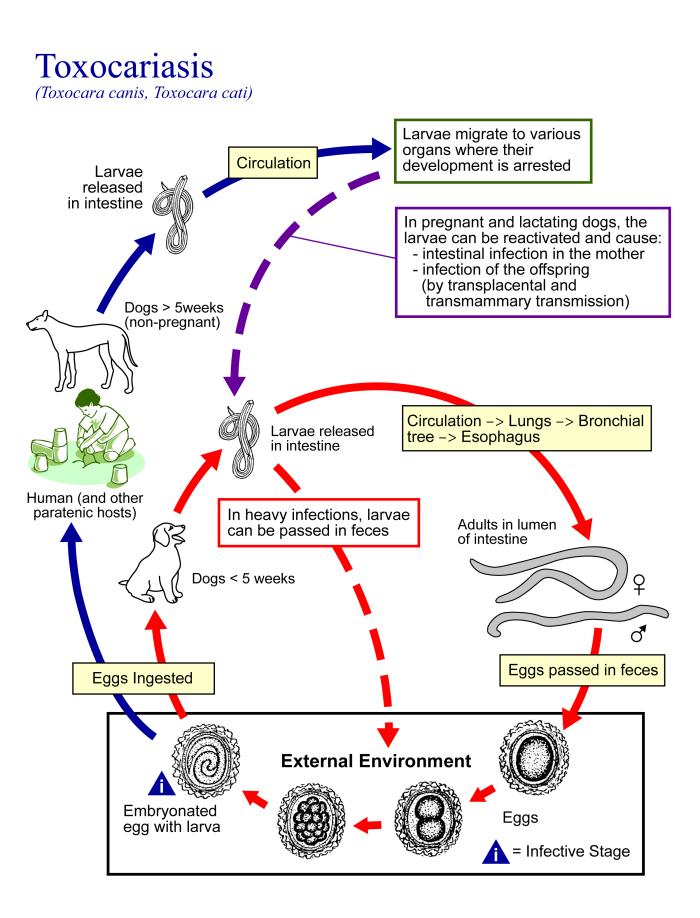
En los cánidos la vía de infección oral es por ingesta de huevos infectantes o accidentalmente al ingerir hospedadores de transporte. En el intestino delgado, en perros jóvenes, emergen las larvas de los huevos, se introducen en la pared intestinal y por el torrente sanguíneo llegan, a través del corazón derecho, pulmón y tráquea, nuevamente al intestino, donde después de varias mudas alcanzan la madurez sexual (migración traqueal). La prepatencia, es decir el período desde la ingestión del elemento infectante hasta su eliminación, es de aproximadamente 30 días. La evolución en los perros adultos es la misma hasta la migración al pulmón. Allí las larvas pasan a la zona capilar de la vena pulmonar y llegan por la circulación mayor a los órganos y a la musculatura donde permanecen vivas durante varios años. El suelo de los parques y patios de recreo está contaminado comúnmente con los huevos de T canis, huevos que obviamente también desembocan necesariamente al agua y en los alimentos. La infección puede causar enfermedad humana que implica a: hígado, corazón, pulmón, músculo, ojo y el cerebro. En los niños, la toxocariasis encubierta es subclínica, enfermedad febril leve, tos, dificultad para dormir, dolor abdominal, dolores de cabeza y problemas de comportamiento. El examen puede revelar hepatomegalia, linfadenitis, y / o sibilancias. Larva migrans visceral es causada por la migración de las larvas a través de los órganos internos de los seres humanos y la reacción inflamatoria resultante. Los casos graves pueden conducir a la miocarditis o insuficiencia respiratoria. Larva migrans ocular, que es causada por la migración de la larva en el segmento posterior del ojo, tiende a ocurrir en niños mayores y adultos jóvenes. Los pacientes pueden presentar disminución de la visión, ojos rojos o leucocoria (aspecto blanco de la pupila). Granulomas y coriorretinitis pueden ser observados en la retina, especialmente en la mácula.
El suelo juega un rol muy importante en la diseminación de esta zoonosis parasitaria. En el hombre la infección es siempre oral no transmitiéndose de persona a persona. La toxocariosis es una parasitosis larval sistémica, que se presenta en forma asintomática o con diversas manifestaciones, como compromiso respiratorio, eosinofilia, fiebre, hepatomegalia, esplenomegalia, hipergammaglobulinemia, adenopatías, afectación del sistema nervioso central, miocardio y piel, pudiendo ser incluso mortal. Clínicamente puede presentarse como síndrome de larva migrans visceral, síndrome de larva migrans ocular, toxocariosis neurológica y toxocariosis encubierta, siendo muy común principalmente en niños. El diagnóstico de la toxocariosis implica la detección de anticuerpos mediante pruebas serológicas, evaluadas en el contexto clínicoepidemiológico del paciente. El diagnóstico puede confirmarse mediante la identificación de larvas en el material de biopsia de los órganos comprometidos. Actualmente existen técnicas moleculares que permiten detectar diferentes estadíos o fracciones de ADN parasitario. Los gusanos adultos de las especies de Toxocara viven en el intestino delgado de los perros y cachorros y rango de 4-12 cm de longitud. Casi todos los cachorros se infectan durante o poco después del nacimiento. Durante el verano, en condiciones de humedad, huevos de Toxocara están embrionados en 2-5 semanas y se vuelven infecciosos.
Sobreviven durante años en el medio ambiente y los seres humanos normalmente ingieren los huevos a través del contacto oral con las manos contaminadas. Una vez introducido en el intestino humano, los huevos de decorticación, la liberación de las larvas. La forma larval sólo es visible bajo el microscopio debido a que es menos de 0,5 mm de longitud y 0,02 mm de ancho. Las larvas penetran en la pared intestinal y migran a través de los vasos a los músculos, el hígado y el pulmón y, a veces para el ojo y el cerebro. La gravedad de la enfermedad depende no sólo del número de larvas ingeridas, sino también en el grado de la reacción alérgica. Los pacientes con atopia pueden experimentar toxocariasis más grave. Las manifestaciones patológicas son el resultado de la inflamación causada por la respuesta inmune dirigida contra los antígenos de excreción-secreción de larvas. Toxocariasis ocular puede inducir disminución de la agudeza visual, la uveítis, granuloma de retina, endoftalmitis, y otras lesiones oculares que a menudo conducen a la pérdida de visión repentina en el ojo afectado. Si el cerebro está involucrado, pueden aparecer manifestaciones neurológicas, incluyendo convulsiones. Debido a que la población de inmunoglobulina-positivo anti-Toxocara es mucho mayor que la prevalencia de la toxocariasis clínica, se cree que la mayoría de los pacientes tener una infección subclínica.
La toxocariasis es una infección en todo el mundo. Los estudios seroepidemiológicos muestran una tasa de 2-5% positivo en adultos sanos de los países occidentales urbanas y 14,2 a 37% en las zonas rurales. Es casi siempre una afección benigna asintomática y autolimitada, aunque la participación del cerebro puede causar morbilidad grave. Compromiso del cerebro puede provocar meningitis, encefalitis o la epilepsia. No se han notificado predilección étnica de toxocariasis. Sin embargo los estudios realizados por los Centros para el Control y la Prevención de Enfermedades (CDC) han descubierto que, entre todos los grupos de edad, toxocariasis es más común en la raza negra no hispana que en los mexicano-americanos y los blancos no hispanos. Toxocariasis no tiene predilección sexual. Estudios de los CDC han demostrado que la transmisión de las larvas de Toxocara es más común en los niños pequeños y las personas menores de 20 años. La toxocariasis es predominantemente una enfermedad de los niños, por lo general los mayores de 2-7 años. Toxocariasis ocular es más común en niños mayores y adultos jóvenes. En el hombre la forma de adquirir la toxocariosis, es siempre oral, por diferentes vías. Esta parasitosis no se transmite de una persona a otra. La vía oral directa o geofagia (hábito de ingerir tierra, aparentemente por carencia de hierro) es frecuente en los niños, pacientes psiquiátricos o embarazadas. La vía oral indirecta puede presentarse al consumir frutas y verduras mal higienizadas, por manos contaminadas con tierra, por ingestión de tejidos de hospedadores paraténicos o huésped de transporte (ej. ratones, lombriz de tierra, cucarachas, pollos, ovinos y otros) que contienen estados juveniles o ingesta accidental de huevos infectivos que ensucian el pelaje de animales, concomitantemente con hábitos promiscuos y falta de higiene.
Larva Migrans Ocular (LMO) puede cursar con leucocoria, uveítis, granulomas retinianos o endoftalmitis crónica, estrabismo, con una importante disminución de la agudeza visual e incluso pérdida total de la misma. Es más frecuente en general en niños mayores de 10 años y suele cursar sin la característica eosinofilia de las otras formas de toxocariosis. Toxocariosis neurológica presenta manifestaciones que varían según la localización de las larvas que actúan como focos irritativos, produciendo lesiones similares a pequeños tumores que pueden desencadenar un importante compromiso neurológico como encefalitis, meningitis, mielitis, convulsiones epileptiformes, trastornos conductales, hipoestesias, paraparesias y vejiga neurógena espástica e incluso hemiplejía. Toxocariosis encubierta se presenta cuando la larva se localiza en músculo estriado, con nula o escasa sintomatología, general e inespecífica. Los factores que determinan la aparición de una una u otra forma clínica son el número de huevos larvados ingeridos, la persistencia de la fuente de contagio en el ambiente, la edad del huésped, la capacidad y velocidad de desarrollar respuesta inmune, por parte de éste.
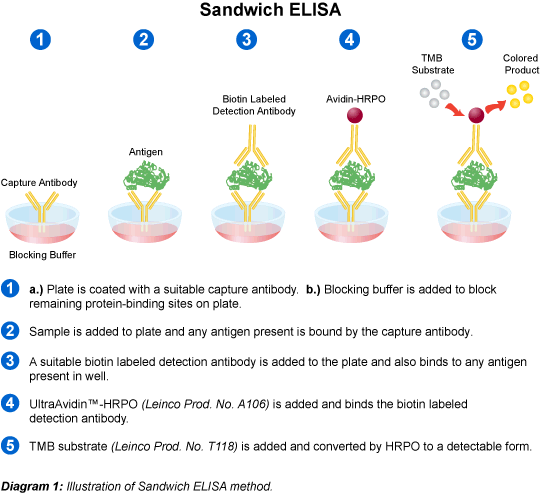
El diagnóstico de la toxocariosis en el hombre implica el conocimiento de los antecedentes epidemiológicos y clínicos del paciente, así como pruebas de laboratorio. Al ser el hombre un hospedador accidental no definitivo y no desarrollar, por consiguiente, el verme adulto, y dada la localización hística de las larvas, el abordaje diagnóstico etiológico puede implicar el estudio histopatológico del material de biopsia de diferentes órganos comprometidos. El hallazgo de larvas en los tejidos constituye un diagnóstico de certeza. Sin embargo, dada la invasividad y escasa eficacia de esta metodología, es de muy poca aplicabilidad en la mayoría de los casos. Así, el acercamiento diagnóstico se basa en la detección de anticuerpos mediante pruebas serológicas. La mayoría de éstas se basan en enzimoinmunoensayos (ELISA) que emplean antígenos de excreción/secreción de larvas L2 / L3 de T. canis que tienen diferentes. La confirmación habitualmente se efectúa mediante Western Blot, prueba muy específica cuando se consideran las bandas de bajo peso molecular de 24, 30-35, 55 y 70 kDa, evitándose las reacciones cruzadas con otros helmintos. Dada la persistencia de los anticuerpos en el tiempo luego de la primoinfección, es difícil diferenciar la infección aguda de la pasada, por lo que los resultados serológicos deben ser evaluados en el contexto clínico epidemiológico del paciente.
Una prueba que aparece como promisoria en la determinación del status infectivo del paciente es la de ELISA-Avidez-IgG que emplea urea como agente disociante de los complejos antígeno-anticuerpos. Los anticuerpos de baja avidez se relacionan con infecciones recientes, mientas que los de alta avidez con infecciones pasadas o crónicas. Es de destacar que en numerosos casos de LMO la serología puede no ser concluyente y los anticuerpos séricos se presentan en bajos niveles o se hallan ausentes, por lo que su confirmación puede realizarse mediante la detección de anticuerpos específicos anti-Toxocara, producidos localmente en el ojo. En esta zoonosis es importante el diagnóstico sobre los hospedadores definitivos, los caninos, el que se lleva a cabo sobre muestras de materia fecal a fin de identificar, o bien el verme adulto, o realizar la búsqueda de huevos mediante métodos de enriquecimiento. El suelo es también material suceptible de análisis en los estudios epidemiológicos, investigándose la presencia de huevos del parásito. Actualmente existen técnicas moleculares que permiten detectar diferentes estadíos o fracciones de ADN parasitario.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.