FASCIOLIASIS o DISTOMATOSIS (cie-10 b 66.3)
Esta parasitosis llamada también Distomatosis Hepática, es una zoonosis común en animales herbívoros, y menos frecuente como enfermedad humana. Es una zoonosis de interés creciente en medicina veterinaria por su impacto económico en la industria (ganado bovino, ovino y caprino). Fasciola hepatica es un trematodo digenético con forma de hoja (parte anterior cónica y posterior ensanchada). Tiene un ciclo biológico complejo, los animales hervíboros y el hombre son los huéspedes definitivos y el caracol del género Limnaea es el huésped intermediario. El hombre se infecta accidentalmente.
Es un parásito aplanado en forma de hoja, de apariencia carnosa y color café claro, con extremo anterior saliente en forma de cono. Mide aproximadamente de 2 a 3 cm de largo por 1 cm de ancho y en la parte anterior presenta dos ventosas. Son hermafroditas y los órganos genitales masculino y femenino (vitelaria), están muy desarrollados, ramificados y poseen un orificio o poro genital cercano a la ventosa ventral.
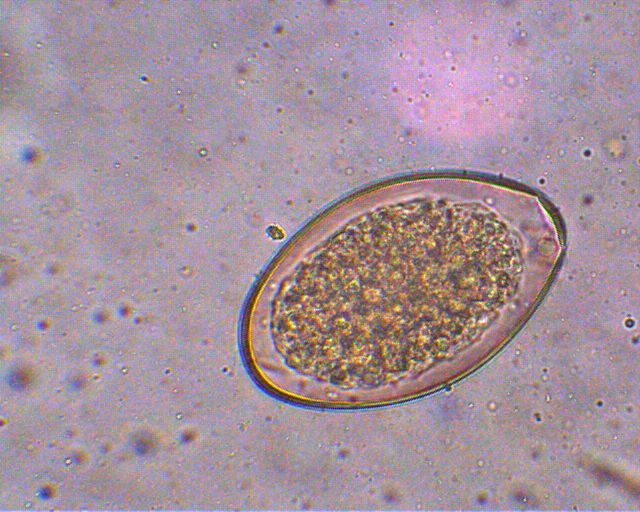
El aparato digestivo consiste en faringe, esófago y el ciego dividido en dos tubos ramificados. Fasciola gigantica es más larga que F. hepática y se encuentra en Africa y Asia, con menor prevalencia que ésta. Los huevos son ovalados y con un opérculo o tapa en uno de sus extremos, miden aproximadamente 150 micras en su longitud mayor. Tienen color café debido a la pigmentación biliar.
Los parásitos adultos se localizan en los conductos biliares de los animales y del hombre. Los huevos salen al intestino con la bilis y son eliminados en las materias fecales. Para embrionar es indispensable que caigan al agua dulce, en la cual dan origen a la primera forma larvaria que sale a través del opérculo. Este es el miracidio ciliado que nada libremente en el agua e invade un caracol del género Lymnaea en el cual se reproduce y forma esporoquistes, redias y cercarias, estas últimas tienen cuerpo redondeado y cola no bifurcada, abandonan el caracol, nadan en el agua para buscar plantas a las que se adhieren y se transforman en metacercarias de aproximadamente 0.5 mm, redondeadas y cubiertas de una membrana gruesa.
Estas metacercarias se encuentran dentro del tejido vegetal, de modo que no son eliminadas con el lavado de las plantas parasitadas. Los huéspedes definitivos se infectan al ingerir estas plantas contaminadas, de las cuales los berros comestibles son la principal fuente de infección humana. En el intestino delgado se libera el parásito inmaduro, que atraviesa la pared intestinal, el peritoneo y la cápsula hepática, para luego buscar los canales biliares en donde se desarrolla a adulto en 3 a 4 meses. Se estima que 2 millones de personas están infectadas principalmente en zonas de cría de ganado ovino.
En la sub región Latinoamericana los países afectados son Bolivia, Chile, Cuba, Ecuador, Perú y Argentina (en particular, las provincias de Córdoba, Mendoza y San Luis). Los hervíboros y el hombre eliminan en las heces los huevos (70 % de viabilidad) que maduran en el agua y en 1-2 semanas liberan larvas móviles o miracidios que nadan rápidamente y en 8-24 horas debe hallar un caracol pequeño del género Limnae, penetra por los tentáculos o pie del caracol y en el pulmón se transforma en el segundo estadío larval que con temperatura adecuada (9-26ºC) evoluciona al tercer estadío o redia que migra al hepatopáncreas del caracol y da lugar al cuarto estadío larval o cercarias.
Las cercarias abandonan el caracol, se desplazan en el agua, se adhieren a las plantas y se enquistan (quinto estadío larvario o metacercaria). Los animales o el hombre ingieren los vegetales (berro, perejil, menta, etc.) contaminados.

La patología de la fasciolosis se puede dividir en 3 etapas de acuerdo a la localización de los parásitos. La primera corresponde a la invasión con lesiones en intestino, peritoneo e hígado, en los cuales produce inflamación y pequeños abscesos con eosinófilos. Las metacercarias ingeridas se transforman en el intestino en fasciolómulos que atraviesan la pared y se desplazan por el peritoneo, perforan la cápsula de Glisson y se movilizan por el parénquima hepático hasta su ubicación definitiva en los conductos biliares.
La segunda fase latente, corresponde a la llegada y crecimiento de los parásitos jóvenes del hígado, la cual dura meses o años. Puede pasar clínicamente desapercibida, pues apenas se está iniciando la fibrosis y la obstrucción y siempre se acompaña de elevada eosinofilia circulante.
La tercera u obstructiva, corresponde al establecimiento de los parásitos en los conductos biliares intrahepáticos; hay inflamación, abscesos, hiperplasia celular, hepatomegalia y finalmente fibrosis. Pueden presentarse localizaciones erráticas que son menos frecuentes; éstas incluyen vesícula biliar, colédoco, peritoneo, pulmón, tejido subcutáneo, etc; en estas circunstancias la patología consiste en nódulos de 5 a 20 mm y lesiones producidas por la migración con inflamación y fibrosis.
El período de incubación dura de 6-16 semanas. En la fase aguda o invasiva (migración larvaria en el peritoneo e hígado) las manifestaciones clínicas son: dolor abdominal generalizado o localizado en el hipocondrio derecho, fiebre intermitente, malestar general, pérdida de peso, urticaria, tos, disnea, dolor torácico, cambio de hábitos intestinales, náuseas, hiporexia. Puede haber hepatomegalia y aumento de las enzimas hepáticas. La eosinofilia es constante y puede haber anemia. Los síntomas se prolongan 2-4 meses. En la fase latente (migración de las larvas a la vía biliar). En la fase obstructiva la obstrucción biliar intermitente cursa con dolor epigástrico o en el hipocondrio derecho, simulando un cólico biliar o una colecistitis, ictericia, intolerancia a las grasas, náuseas.
La litiasis biliar o del colédoco es una secuela común. Un buen número de pacientes son asintomáticos y corresponden a infecciones con pocos parásitos. La sintomatología se inicia con una fase aguda o invasiva caracterizada por un síndrome febril acompañado de hepatomegalia dolorosa y elevada eosinofilia. Puede presentarse urticaria y síntomas digestivos. La segunda fase o latente puede ser asintomática mientras llegan los parásitos a los conductos biliares y la tercera u obstructiva sucede cuando la enfermedad se establece, el dolor hepático es más acentuado y de tipo cólico biliar muy similar a colecistitis. En casos graves hay anorexia, pérdida de peso, fiebre persistente, reacciones alérgicas e ictericia por obstrucción. En algunos casos los pacientes consultan por cuadros clínicos de obstrucción biliar, empiema o abscesos, los cuales pueden requerir intervención quirúrgica y dan lugar al diagnóstico etiológico por el hallazgo del parásito.
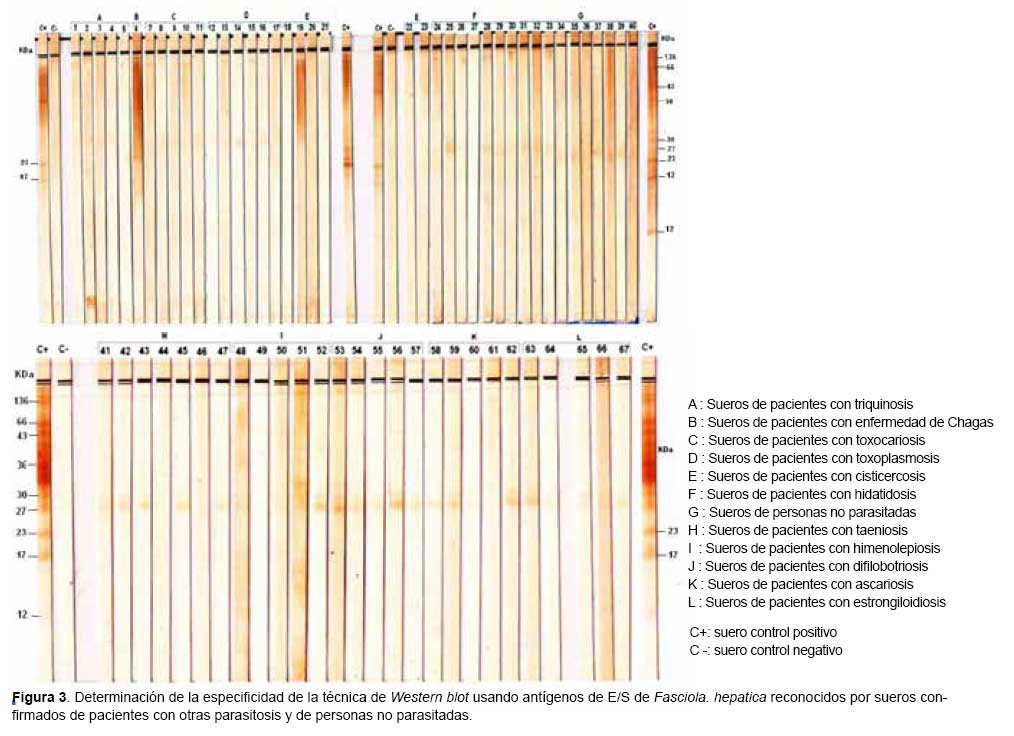
Por métodos auxiliares: en la fase aguda, eosinofilia y hallazgos en la ultrasonografía hepática y abdominal (múltiples lesiones hipodensas), por laparoscopía se observan nódulos en la cápsula hepática, por serología (ELISA de captura; Fast-ELISA, sensibilidad 95-100 % y especificidad 98 %; ELISA sandwich, sensibilidad 97 % y especificidad 100 %). En la fase crónica la identificación de los huevos en muestras seriadas de material fecal por cuanto la eliminación es baja. Si se practica cirugía de la vía biliar, se remueven los parásitos adultos. El modo más frecuente de establecer el diagnóstico etiológico es por el hallazgo de los huevos en la bilis, contenido duodenal o materias fecales.
Existen diagnósticos falsos positivos cuando se encuentran huevos al coprológico, en pacientes que han ingerido hígado crudo o mal cocido, con parásitos; en estos casos el hombre no sufre la infección sino que elimina los huevos ingeridos. Hay aumento de leucocitos y elevada eosinofilia. Las pruebas hepáticas, como las transaminasas, pueden estar aumentadas. Los parásitos adultos se encuentran en el acto quirúrgico y su identificación confirma la parasitosis. En el diagnóstico de la enfermedad son útiles los estudios radiológicos, pruebas hepáticas, el leucograma, etc., así como pruebas inmunológicas, tales como contrainmunoelectroforesis, ELISA, hemaglutinación indirecta y reacciones de precipitación. Recientemente se han utilizado pruebas más modernas como identificación de antígenos y de complejos inmunes circulantes.
La fasciolosis en una enfermedad de mayor importancia veterinaria que humana, principalmente en ganado vacuno y ovino, aunque también afecta caballos, cerdos, conejos, etc. En América Latina la parasitosis humana ha sido descrita principalmente en Chile y Argentina. Debido al mecanismo de infección al ingerir berros, como verduras para consumo humano, pueden existir brotes familiares. Las medidas de prevención consisten en evitar el consumo de plantas acuáticas que se utilizan crudas para la alimentación y en el control de los caracoles que actúan como huéspedes intermediarios, mediante moluscocidas. Tratamiento: Bithionol (de elección) en dosis de 30-50 mg/kg/día en tres tomas en días alternos y durante 10-15 días. Triclabendazol en dosis única de 10-12 mg/kg/día uno o dos días.
HIDATIDOSIS o EQUINOCOCOSIS (CIE-10 b67.0 - b67.4)
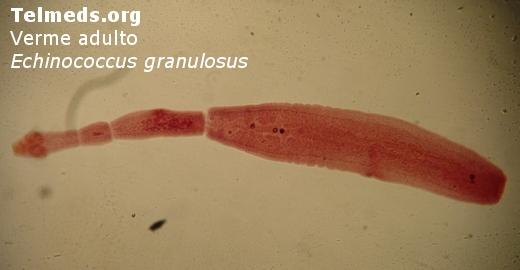
Esta infección es conocida desde antiguo, fue descrita por Hipócrates. Es una zoonosis, enfermedad producida en los animales y en el hombre por las formas larvarias (metacéstodos.) de varios géneros del céstodo Echinococcus cuyo ciclo de vida comprende dos hospedadores: uno carnívoro (definitivo), con los parásitos adultos en el intestino y uno herbívoro u omnívoro (intermediario), que presenta las formas larvarias en los tejidos. El hombre está dentro de este último grupo, como hospedador accidental. Los adultos de Echinococcus viven en el intestino delgado de los huéspedes definitivos, principalmente miembros de las familias Canidae y Felidae, con infecciones múltiples, en general bien toleradas por estos animales.
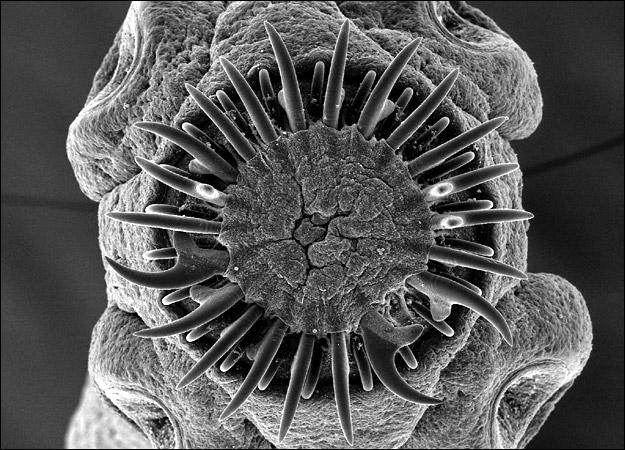
Tienen escólex con 4 ventosas y doble corona de ganchos y dos a 5 proglótides. Miden de 2 a 10 mm de longitud y pueden diferenciarse por varias características morfológicas. Los huevos son liberados del proglótide final o grávido en el intestino y eliminados en las materias fecales. Su morfología es igual a los huevos de Taenia. Existen 3 especies de Echinococcus que producen más frecuentemente enfermedad humana, E. granulosus, E. multilocularis y E. vogeli cuyos quistes hidatídicos dan origen a 3 enfermedades con huéspedes diferentes, distinta distribución geográfica y formas clínicas propias. Existe una cuarta especie en el trópico americano, llamada E. oligarthrus, cuyo huésped definitivo es el gato salvaje, del cual se conoce únicamente tres casos de infestacion humana.
Tiene distribución mundial y es una enfermedad endémica, particularmente de las poblaciones rurales, dedicadas a la cría de ovinos, bovinos y equinos. La tasa de incidencia/100.000 habitantes es de 8 en Chile, 5 en Uruguay y 1,4 en Argentina (Neuquén es la provincia con mayor incidencia, 20-88). La etnia quechua en Perú tiene una alta incidencia. En los Estados Unidos se han identificado casos en varios Estados (Nuevo México, Arizona, Utah, California, etc.). El 7,3 % de los vacunos (n=3.662.000) y el 12,3 % de los ovinos (n=913.000) faenados e inspeccionados por el Servicio Nacional de Salud Animal de Argentina tenían hidatidosis en el período 1988-1992. La transmisión se realiza en forma directa por las manos contaminadas con huevos que se llevan a la boca luego del contacto con perros y en forma indirecta por los alimentos y el agua contaminados. Un perro parasitado puede alojar hasta 40.000 cestodos y cada uno elimina alrededor de 500 huevos/semana.
Hidatidosis quística o unilocular
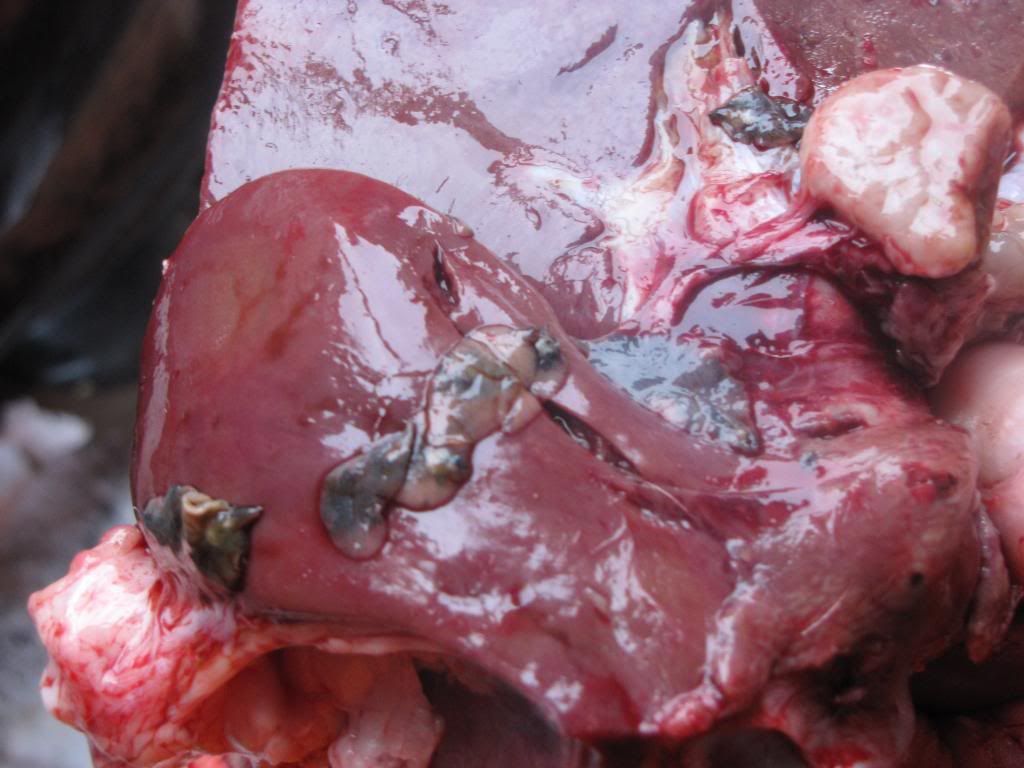
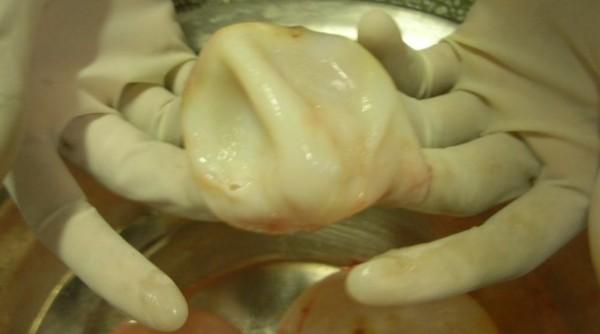
Es la más común y presenta la distribución geográfica más amplia. Es producida por larvas de E. granulosus, cuyos huéspedes definitivos principales son perros domésticos y salvajes. Los huéspedes intermediarios naturales son ungulados, principalmente ovejas. Predomina en regiones donde los perros son utilizados para ayudar con los rebaños de animales ovinos. Es un quiste con una sola cavidad, que puede ser único o múltiple, redondo u ovalado, de tamaño variable según el tiempo de evolución. Los quistes de muchos años pueden medir 20 cm de diámetro o más.
Poseen tres membranas: una externa o adventicia, producida por el huésped, de tipo granulomatoso, que permite el desprendimiento fácil del quiste y dos membranas producidas por el parásito, una mediana o laminada que actúa como soporte, acelular, de pocos milímetros y una interna o germinativa de 20 micras de espesor, que da origen a formas reproductivas asexuadas, llamadas vesículas prolígeras. Estas son inicialmente muy pequeñas, crecen y forman en su interior muchos escólices, llamados protoescólices que miden de 100 a 200 micras, tienen ventosas y ganchos y generalmente están invaginados. Las vesículas prolígeras, los quistes hijos y protoescólices sueltos, forman un granulado que puede observarse macroscópicamente en el interior del quiste, el cual se ha llamado arena hidatídica. Los quistes son de crecimiento muy lento y pueden llegar a contener varios litros de líquido y miles de protoescólices.
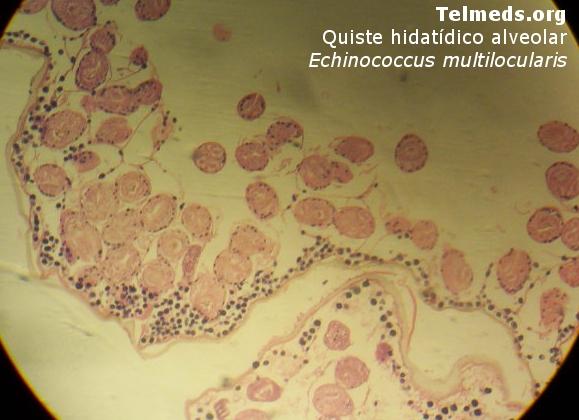
Hidatidosis alveolar o multilocular
Le sigue en frecuencia a la unilocular y está distribuida en la zona norte del hemisferio (región holoártica). Es producida por E. muitilocularis, cuyos huéspedes definitivos principales son zorros, aunque también pueden ser perros y gatos. Los huéspedes intermediarios son roedores. Las formas larvarias son quistes múltiples en racimo, infiltrativos, con bordes indefinidos que invaden los tejidos de manera similar al cáncer. Se presenta principalmente en el hígado, pulmón y cerebro.
Hidatidosis poliquística
Es la de más reciente descripción en el trópico americano (región neotropical). Es producida por E. vogeli, un parásito de animales selváticos carnívoros, principalmente el perro de monte o zorro guache (Speothus venáticus), otros cánidos selváticos y el perro doméstico. El quiste es múltiple e infiltrativo como el multilocular, con invasión de tipo neoplásico a las visceras. El estudio microscópico muestra los ganchos, las membranas con vesículas prolígeras y protoescólices que hacen parte de la arena hidatídica.
El hombre adquiere la hidatidosis por la ingestión de huevos de Echinococcus presentes en alimentos, agua, manos u otras fuentes contaminadas con materias fecales de los huéspedes definitivos. En el intestino delgado se liberan las larvas, penetran la pared para buscar la circulación porta y localizarse en hígado, pulmón y otros órganos. En el lugar donde se establecen, crecen lentamente hasta formar quistes, que pueden alcanzar gran tamaño. Los huéspedes definitivos se infectan al comer visceras crudas que contengan los quistes. Cuando esto sucede, los protoescólices se desarrollan a parásitos adultos en el intestino delgado, se adhieren a la mucosa y producen huevos que son eliminados con las materias fecales. La infección con parásitos adultos es múltiple, por lo cual la eliminación de huevos es muy abundante.
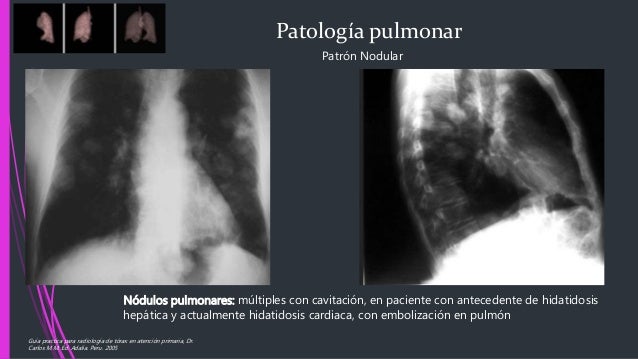
En el hombre la localización más frecuente de los quistes es hígado y pulmón. Otras localizaciones son: cavidad abdominal, sistema nervioso, ríñones, bazo, músculos, huesos, etc. La patología que causa el quiste intacto es por compresión, desplazamiento o por ocupación de espacio, lo cual sucede de manera lenta y progresiva. Cuando hay ruptura, se presentan complicaciones severas debidas a reacciones de hipersensibilidad o implantaciones de múltiples quistes. Los quistes muertos y de larga evolución, tienden a calcificarse.
La ruptura de un quiste desencadena reacciones irritativas de hipersensibilidad y aun choque anafiláctico que puede ser fatal. Además se producen implantaciones múltiples que dan origen a hidatidosis secundarias, principalmente en peritoneo, pleura y pulmón. En cualquiera de sus localizaciones, el quiste se puede infectar secundariamente y formar un absceso, en cuyo caso la sintomatología se agrava y aparece fiebre y leucocitosis.
El diagnóstico clínico diferencial debe hacerse principalmente con las enfermedades tumorales que afectan hígado y pulmón. Secundariamente con lesiones en cualquier otro órgano que produzcan patología por compresión, o que se manifiesten por una masa de tipo tumoral. En los exámenes corrientes de laboratorio puede observarse únicamente la eosinofilia, que es común a otras parasitosis. La observación de los quistes por laparoscopia, laparotomía u otros procedimientos usuales, permite presumir el diagnóstico con mayor certeza. El diagnóstico se completa con pruebas de laboratorio que se pueden dividir en inmunológicas, radiológicas y parasitológicas.
Pruebas inmunológicas: a) reacción de hipersensibilidad tardía, que se conoce como prueba de Casoni. en la cual se inyecta intradérmicamente antígeno obtenido del líquido de los quistes; b) reacciones serológicas: inmunoelectroforesis, ELISA, hemaglutinación indirecta y prueba de látex. La primera es de gran valor diagnóstico cuando se logra demostrar la presencia del arco 5, descrito por Caprón. Las dos pruebas más utilizadas son inmunoelectroforesis y ELISA, que presentan 100% de especificidad. Se ha ideado un microelisa que es rápida y de bajo costo. También se utiliza el inmunoblot con antígenos purificados. Uno de estos antígenos obtenido de E. vogeli. permite diferenciarlo de E. granulosas.
Métodos radiológicos: La radiografía simple puede demostrar la lesión y es más utilizada en las localizaciones pulmonares. La ecografía. la escanosrafía y la resonancia magnética son los mejores métodos diagnósticos. Las formas poliquísticas se observan como zonas de menor densidad, múltiples, de tipo invasivo y con calcificaciones. El diagnóstico por imágenes es fundamental (radiografía, ultrasonografía, tomografía axial computada, resonancia magnética nuclear) permiten definir con precision la lesión y sus características. Las técnicas serológicas son ELISA, HAI, inmunodifusión (arco 5), inmunoblot. Un estudio serológico negativo no descarta la infección.
Diagnóstico parasitológico: Se hace al observar cualquiera de los componentes del quiste a simple vista y al microscopio. Este diagnóstico se puede hacer de material eliminado espontáneamente u obtenido en cirugía o autopsia, pero nunca se debe puncionar el quiste mientras no sea removido del paciente por el grave peligro de desencadenar una reacción anafiláctica. El diagnóstico macroscópico de las formas poliquísticas es más difícil que el de las uniloculares, debido a que presentan una apariencia tumoral.
El diagnóstico microscópico en preparaciones teñidas por hematoxilina-eosina y PAS, se hace por la morfología del tejido, la presencia de protoescólices y las características de los ganchos, con forma y proporción de medidas de las distintas partes. Estas medidas se obtienen mejor de ganchos completos sin colorear, obtenidos del líquido vesicular o por compresión del quiste. Otras anormalidades en exámenes de laboratorio encontradas frecuentemente son: aumento de las transaminasas y de las fosfatasas alcalinas, hipergammaglobulinemia (muy alta en las formas poliquísticas) y eosinofilia.
La hidatidosis unilocular por E. granulosus está presente en zonas de Asia, Africa y Australia y en América del Sur, principalmente Argentina, Uruguay, Chile, Perú y sur del Brasil. El hombre se infecta al ingerir huevos del parásito eliminados en las heces fecales de los perros infectados. Estos a su vez se han contaminado al ingerir visceras crudas de ovejas, que son los principales huéspedes intermediarios. Estos animales, que viven en íntimo contacto con perros pastores, se infectan al ingerir huevos del pasto donde han caído las materias fecales de los perros. Los huevos son muy resistentes a las condiciones ambientales y pueden ser transportados a distancia por el viento. En los países nórdicos del mundo se han encontrado cepas selváticas de E. granulosus. que tienen su ciclo entre carnívoros y herbívoros salvajes.
La hidatidosis alveolar por E. multilocularis predomina entre los esquimales y al norte de Europa y Asia. Los principales huéspedes definitivos son los zorros, aunque también se encuentra en perros y gatos. Los huéspedes intermediarios son diferentes roedores. Las personas más expuestas a la infección son cazadoras y aquellas dedicadas al trabajo con pieles de zorro. La prevención se realiza con cuidados higiénicos en el hombre, evitando alimentar los perros con visceras crudas que tengan hidatidosis y tratándolos con praziquantel para curar la equinococosis intestinal. Es básico el desarrollo de la educación para la salud en las comunidades expuestas:
Evitar la exposición ambiental a heces de perros, el consumo de vísceras crudas por los perros.
Realizar el faenamiento en condiciones adecuadas con supervisión sanitaria.
Incinerar o enterrar las vísceras.
Reducir el número de perros y desparasitarlos periódicamente.
Lavar cuidadosamente las manos.
La extirpación quirúrgica es el método más eficiente en la forma unilocular. Para ello se han ideado técnicas especiales que permiten la extirpación del quiste intacto, para evitar su ruptura, en cuyo caso se pueden originar reacciones anafilácticas y siembras de la hidatidosis. En los casos alveolares y poliquísticos la cirugía es más difícil o es impracticable por las características invasivas de la enfermedad. En cualquiera de las 3 formas se usó con algún éxito el mebendazol, pero en la actualidad la experiencia es mejor con albendazol, el cual se absorbe en mayor cantidad en el intestino.
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HABITO" ARISTOTELES