(El Autor)
GUÍA PRACTICA del LABORATORIO MICROBIOLOGICO
en AGUA y ALIMENTOS (Parte XVI)
Salmonella y Shigella
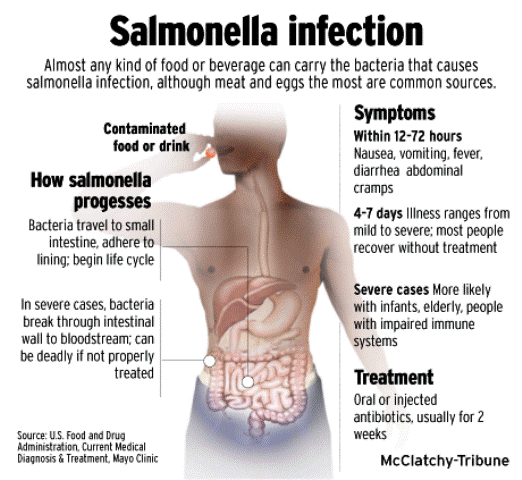
El aislamiento e identificación de Salmonella sp. es un proceso complejo que consta de varias fases; el recuento generalmente no se practica. Una vez tomada la muestra del alimento (25 g, según lo normatizado en el CAA) se mezcla con un medio de preenriquecimiento, como el caldo lactosado en una cantidad de 225 ml. Este paso podría llegar a obviarse con aquellos alimentos que ya contengan lactosa en su composición (farináceos, pastelería, etc). El caldo se incuba entonces unas pocas horas (8) a 37 ºC para facilitar la recuperación de las salmonelas lesionadas. La segunda fase implica la siembra de una muestra de caldo en un medio de enriquecimiento que favorezca el crecimiento de las salmonelas a la vez que restringe o inhibe por completo el desarrollo de microorganismos competidores, como los coliformes. El término enriquecimiento selectivo se usa con carácter general para indicar que a un microorganismo o a un grupo de ellos se le permite crecer mientras que se inhiben los competidores; en esencia en esta fase se busca que aumente la proporción del microorganismo(s) requerido(s) respecto a todos los competidores. Los dos medios de enriquecimiento corrientemente utilizados con las salmonelas son el Caldo de Selenito – Cistina y el Caldo Tetrationato. El primero contiene selenito sódico, como agente inhibidor, aunque la hidrólisis de la lactosa que también forma parte del medio y que llevan a cabo muchas de las bacterias entéricas presentes, da lugar a una caída del pH que favorece el crecimiento de las salmonelas.
El caldo de tetrationato contiene varios agentes inhibidores como sales biliares, verde brillante y tetrationato que, en combinación, permiten que crezcan las salmonelas mientras que se inhiben eficazmente la mayoría de sus competidores. La incubación de estos caldos se realiza a 37º C durante 24 horas. Después del enriquecimiento los caldos se emplean como inóculo de placas de medios selectivos, habiéndose empleado con este fin, tanto Agar SS como Agar-rojo violeta-bilis. No obstante, ahora se usan generalmente agar de MacConkey-verde brillante y agar desoxicolato-citrato; ambos contienen diversos agentes selectivos, los nutrientes usuales, lactosa y un indicador de pH. Las salmonelas al no fermentar la lactosa forman en estos medios después de una incubación de 24 horas a 37º C, colonias verdes e incoloras, respectivamente y por lo tanto se distinguen fácilmente de las colonias rojas originadas por los microorganismos fermentadores de la lactosa. Desgraciadamente muchos otros microorganismos dan en estos medios colonias indistinguibles de las de Salmonella sp., por lo que se necesitan otras pruebas antes de confirmar su aislamiento. La confirmación se realiza picando las colonias sospechosas y después de comprobada su pureza se resiembran en medios para comprobar la fermentación de otros carbohidratos, la producción de ácido sulfhídrico, la descarboxilación de la lisina y la motilidad.
Con tal que estas pruebas de tamizado (screening) produzcan los debidos resultados, las bacterias aisladas pueden considerarse como salmonelas, llevando a cabo la confirmación final con pruebas serológicas. La caracterización del serotipo específico puede hacerse con los correspondientes antisueros H y O, si bien para la confirmación suele ser suficiente con el empleo de antisueros polivalentes H y O (que son representantes de todos los serotipos que generalmente cabe esperar). Es probable que los concentrados de muestras necesiten ser enriquecidos previamente en agua de peptona amortiguada, para luego ser enriquecidos en caldo que contenga ya sea tetrationato, selenito, cloruro de magnesio o verde de malaquita. Estos, a su vez, pueden ser sometidos a subcultivo en medios como el verde brillante, sulfito de bismuto, agar de desoxicolata xilosa-lisina (DXL), citrato de desoxicolata o agar de MacConkey, examinándose luego las colonias sospechosas tanto bioquímica como serológicamente. Entre las pruebas de depuración bioquímica se deberá incluir: agar triple de azúcar y hierro, producción de indol, decarboxilasa y actividad de ß-galactosidasa. En las pruebas serológicas se incluirá la aglutinación con sueros polivalentes anti-o, anti-H y anti-Vi.
Es imprescindible la eliminación previa de cepas autoaglutinables. Cuando el análisis se realiza para detectar las S. typhi , el medio de cultivo aconsejado es la selenita F. El procedimiento de los tubos múltiples se utilizará para calcular el número de Salmonella presentes en el agua. Debido a que las bacterias coliformes y la mayoría de cepas de Proteus vulgaris son antagónicas a la Shigella, es aconsejable elegir medios enriquecidos selectivos que reduzcan al mínimo las acumulaciones de compuestos volátiles y de los subproductos obtenidos a partir de estos microorganismos antagónicos. Se puede usar caldo nutriente con un pH ajustado de 8,0 (es el nivel de pH que menos favorece el crecimiento de bacterias coliformes). También es posible obtener un buen enriquecimiento de Shigella con un medio de cultivo autocitotóxico con base en caldo de tripticasa de soja conteniendo 1 mmol/litro de 4-cloro- 2-ciclopentilfenil ß-D-galactopiranosida, 2,5 g/litro de lactosa y sustancia amortiguadora de citrato a un pH de 6,2. La incubación debe hacerse durante 6-18 horas, a una temperatura de 35°C. Estríense las culturas en agar DXL cuando hayan transcurrido 6 y 18 horas. Sométanse las colonias sospechosas a pruebas de selección bioquímica y confírmese las colonias sospechosas con antisueros de Shigella (sueros polivalentes y de tipo).
La presencia en alimentos de cualquier serotipo de Salmonella es potencialmente peligrosa como fuente de enfermedad para el hombre, bien por consumo de los alimentos o por contaminación secundaria de utensilios y equipo para el tratamiento e industrialización de otros productos. La norma microbiológica vigente para diversos alimentos (jamón cocido, fiambre de jamón, paleta cocida, fiambre de paleta, magro de cerdo cocido, fiambre de magro de cerdo, gelatinas comestibles, huevo entero pasterizado refrigerado o congelado, yema pasterizada refrigerada o congelada, huevo entero desecado, yema desecada, clara desecada, leche y productos lácteos, nata, etc.) exige la ausencia de Salmonella en 25 g.
a) Enriquecimiento en medio líquido no selectivo. Homogeneizar 25 g de la muestra con 120 ml de agua de peptona estéril, e incubar a 37ºC durante 12-24 horas.
b) Enriquecimiento en medio líquido selectivo. Pasar 10 ml del homogeneizado anterior a un frasco que contenga 100 ml de caldo tetrationato (Müller-Kauffmann). Incubar a 37ºC durante 24 horas. Para detectar ciertos serotipos que pueden no crecer adecuadamente en las condiciones anteriores, puede realizarse un enriquecimiento selectivo complementario en otro medio (generalmente caldo selenito cistina) incubando y también a una temperatura distinta (43ºC).
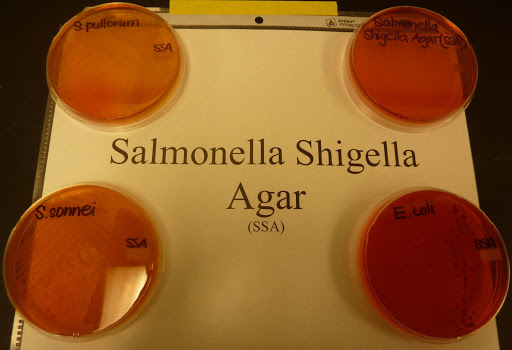
c) Siembra en medios sólidos selectivos. Pasar un asa de siembra del caldo de enriquecimiento a sendas placas de medio selectivo (agar SS Salmonella-Shigella y agar XLD) y extender el inóculo. Incubar a 37ºC durante 24 horas.
d) Estudio de las colonias sospechosas. En agar SS las colonias típicas son incoloras y el medio vira a amarillo, en agar XLD son rojas y transparentes. Algunas cepas dan colonias con el centro negro.
e) Uilización de glucosa y lactosa. De las colonias sospechosas (del agar SS o del XLD) se siembra en superficie en un tubo de agar Kligler incubándose a 37ºC durante 24 horas. La coloración amarilla en el fondo indica la utilización de glucosa, mientras que la de la superficie indica la de lactosa. El fondo negro refleja la presencia de H2S.
f) Utilización de manitol. De las colonias sospechosas (del agar SS o del XLD) se siembra en superficie en un tubo de agar Manitol incubándose a 37ºC durante 24 horas. La coloración amarilla indica la utilización de ese azúcar.
g) Ureasa. De las colonias sospechosas (del agar SS o del XLD) se siembra en superficie en un tubo de agar Urea incubándose a 37ºC durante 24 horas. La presencia de color rosa indica resultado positivo. Se consideran Salmonella las colonias glucosa + y lactosa - en los tubos de agar hierro de Kligler (con o sin fondo negro), manitol + y que además sean negativas a las otras pruebas bioquímicas.
Salmonella pertenece a la Familia Enterobactereaceae, al Género Salmonella. Salmonella y Arizona por la homología de su DNA se le considera una sola; la nomenclatura y clasificación no está establecida definitivamente. Bacilo GRAM (-) aerobio y anaerobio facultativo, producen ácido a partir de la glucosa y son generalmente aerogénicos. Se distinguen 7 distintos subgrupos, cada cual con su fenotipo definido y son serotipificados por antígeno O somático,Vi de superficie y antígenos flagelares fase I y II. Según última clasificación, se establece la siguiente nomenclatura estimándose que el 99% de los aislamientos en clínica corresponde a al subgrupo I. El período de incubación de la enfermedad es desde las 6 hasta 48 hrs dependiendo de la dosis infectante la que puede ser desde 15 a 20 UFC para algunos serotipos. No todos los serotipos son patógenos para el hombre y animales.
La incidencia de salmonelosis se ha visto incrementada en los últimos 20 años estimándose que los casos anuales van desde 740.000 a 5.000.000 de los cuales no más del 1% es detectado. Los factores más importantes para su control pasan por una adecuada educación al consumidor y por la implementación y mantención de adecuados controles de calidad por parte del laboratorio de la industria de alimentos la que preferentemente utiliza métodos rápidos para realizar screening en sus productos mediante kits rápidos los que son eficientes en detectar partidas negativas, pero en el caso de reacciones presumiblemente positivas se debe confirmar con los métodos convencionales. Una de las fuentes principales son los alimentos contaminados con este microorganismo especialmente los alimentos de origen animal y los vegetales regados con aguas contaminadas. Los alimentos se analizan para pesquisar Salmonella por las siguientes razones:
a. Confirmar que este microorganismo fue el agente causal de la intoxicación alimentaria.
b. Determinar qué alimentos o ingredientes de alimentos son fuente de contaminación de Salmonella.
Es la segunda causa más común de enfermedades transmitidas por alimentos. Es responsable de millones de casos al año de enfermedades transmitidas por alimentos; Origen: huevos crudos y mal cocidos, pollos y carnes mal cocidas, productos lácteos, mariscos, frutas y vegetales. Los alimentos comúnmente asociados a intoxicaciones son:
-carne (vacuno, cerdo, pollo),
-productos cárneos (jamón, salame, vienesas),
-ensaladas (papas, porotos verdes, jamón, pollo),
-productos de pastelería (cremas) y
-productos lácteos (queso, queso de cabra, etc).
Staphilococus aureus
Los métodos para el examen de S. aureus pueden agruparse en dos: primero recuento de estafilococos y segundo comprobación de la presencia de enterotoxina en el alimento. Dado que sólo un 50 % aproximadamente de las cepas de S. aureus son enterotoxigénicas, se deduce que en la investigación de brotes de toxiinfecciones alimentarias el segundo método es más concluyente; además, a partir de ciertos alimentos corrientemente se aísla un pequeño número de S. aureus sin que ello debe considerarse peligroso. El rango de medios selectivos, a base de agar, que se ha utilizado para la enumeración de S. aureus en los alimentos es especialmente grande y como en el caso de C. perfringens, la ICMSF ha realizado un estudio comparativo de algunos de los más empleados (Rayman et al., 1978). Concluyó que el Agar de Baird – Parker era el que mejor se comportaba. Este medio (Baird – Parker) contiene como agentes inhibidores telurito potásico y cloruro de litio y como sistema indicador yema de huevo. Previamente el inóculo se lleva a un medio preselectivo como lo es el Caldo Giollitti – Cantoni adicionado con telurito de potasio como inhibidor, incubándose 24 hs a 37° C.
Después de 24 – 48 horas de incubación a 37º C, S. aureus produce en el medio colonias negras rodeadas de una zona clara (de 2 – 5 mm de anchura); en el interior de esta zona hay otra opaca más pequeña que sólo se desarrolla en la última fase de la incubación. Estas reacciones son muy específicas de S. aureus, pero debe hacerse una prueba confirmativa (reacción de la coagulasa). La detección de enterotoxina en los extractos de alimentos o en los filtrados de cultivos aislados de los alimentos sospechosos implica normalmente procedimientos serológicos que son más sensibles y más baratos que las pruebas previamente utilizadas. Dado que las concentraciones de enterotoxina en los alimentos son muy bajas deben emplearse métodos de extracción y concentración; puesto que estas técnicas requieren mucho tiempo, últimamente se han introducido técnicas más rápidas. Los métodos de hemaglutinación y radioinmunoensayo dan los resultados en pocas horas y además no necesitan que se concentren los extractos de los alimentos. S. aureus pertenece a la familia Micrococcaceae, al Género Staphylococcus. El género Staphilococus está constituido por diecinueve especies y se diferencian de otros géneros de la familia, en base al contenido de guanina y citosina (G + C) en el DNA, composición de la pared celular y su habilidad de crecer anaeróbicamente y fermentar la glucosa bajo esas condiciones (Bergdoll, 1979, Kloos y Schleifer, 1986). Las tres especies más conocidas de Staphilococus
S. aureus
S. epidermidis
S. saprophyticus
Se diferencian por su capacidad para:
* producir coagulasa
* fermentar el manitol (aeróbica y anaeróbicamente),
* producir una nucleasa termoestable
* composición de la pared celular
S. aureus es una bacteria inmóvil, Gram positiva, esférica y usualmente agrupada en racimos, anaerobia facultativa, catalasa positiva. Produce generalmente la enzima coagulasa, fermenta el manitol y otros azúcares, formando ácido pero no gas. El crecimiento ocurre en un amplio rango de temperatura 6,5 a 50ºC, siendo el óptimo 30-40ºC. Los Staphylococcus son microorganismos que viven en estrecha relación con el hombre y la gran mayoría de las cepas son potencialmente capaces de causar enfermedad. Staphylococcus aureus es un microorganismo fácilmente destruido por tratamientos térmicos con altas temperaturas y por todos los agentes sanitizantes. Por lo cual la presencia de esta bacteria o sus toxinas en alimentos procesados o en equipos, generalmente indica falta de sanitización o contaminación cruzada. Los alimentos se analizan para investigar S.aureus por las siguientes razones:
* Confirmar que este microorganismo fue el agente causal de la intoxicación alimentaria.
* Determinar qué alimentos o ingredientes de alimentos son fuente de contaminación de Staphylococcus aureus.
* Demostrar contaminación post proceso los cuales usualmente se deben a contacto humano con alimentos procesados o exposición del alimento a superficies inadecuadamente sanitizadas.
Los alimentos comúnmente asociados a intoxicaciones son:
- carne (vacuno, cerdo, pollo),
- productos cárneos (jamón, salame, vienesas),
- ensaladas (papas, porotos verdes, jamón, pollo),
- productos de pastelería (cremas)
- productos lácteos (queso, queso de cabra, etc)
El objetivo de realizar análisis de Recuento de S. aureus es detectar el número de unidades formadoras de colonias (UFC) y el de realizar NMP es estimar la densidad de bacterias S. aureus en un alimento como indicador sanitario. Se aplica el método de recuento en placa en alimentos en los cuales se puede detectar > 100 células /g o ml. Se aplica la técnica NMP en productos en los cuáles el número de S. aureus es bajo, como por ejemplo en alimentos deshidratados o congelados. También es útil en alimentos que contengan una gran población de especies competitivas. Aunque el género Staphylococcus está integrado por un amplio número de especies con posibilidad de producir enterotoxinas es indudable que S. aureus es con mucho la que presenta un mayor porcentaje de cepas enterotoxigénicas y por lo tanto productoras de intoxicaciones por alimentos. La presencia de estafilococos en alimentos puede deberse a una procedencia endógena como consecuencia de infecciones de origen animal, o exógena, a partir de manipuladores fundamentalmente. La investigación de los brotes de intoxicación estafilocócica diagnosticadas en los últimos años señala que la procedencia humana de estos procesos es más frecuente que la animal. Procedimiento: Preparar un homogeneizado del alimento (10 g) en agua de peptona (90 ml) como se ha descrito para los recuentos de microorganismos viables. Pipetear 0,1 ml del homogeneizado inicial (1/10) y de la dilución 1/100 y depositarlo en la superficie de sendas placas de Petri con el medio de Baird-Parker solidificado. Extender con varilla de vidrio previamente esterilizada por inmersión en alcohol y posterior flameado. Incubar a 37ºC durante 24 – 48 h y contar el número de colonias que aparecen en las placas. Se consideran estafilococos sospechosos de ser enterotoxigénicos los que dan colonias de color negro, convexas y rodeadas de un halo más claro en el medio de Baird-Parker. Pruebas confirmativas para estos microorganismos son la prueba de la DNAsa y la de la coagulasa. La desoxirribonucleasa es una poderosa enzima elaborada por las cepas patógenas de S. aureus. A partir de las colonias típicas crecidas sobre Baird-Parker se siembra una estría sobre la superficie del agar DNAsa. Se incuba durante 24 horas a 37ºC. Sobre el crecimiento se vierte HCl 1N y se espera unos minutos a que se produzca la reacción, que consiste en la aparición de una zona transparente alrededor del crecimiento. En un tubo de 10 x 75 mm se vierten 0,3 ml de plasma de conejo EDTA reconstituido. Se le añade una colonia típica y se observa a partir de los 30 minutos. La reacción es positiva cuando el coágulo formado es firme.
Bacillus cereus
En los alimentos sospechosos sólo se requiere la determinación cuantitativa de B. cereus que, para tener importancia, debe alcanzar valores grandes. Los medios selectivos empleados para el recuento de este microorganismo llevan frecuentemente polimixina ya que Bacillus sp., no es afectado por este antibiótico. A menudo se les incorpora un sistema indicador a base de yema de huevo y posiblemente manitol, junto con un indicador de pH; B. cereus se identifica, de forma presuntiva, por la zona opaca que rodea las colonias después de 24 horas de incubación a 37º C, zona que es igual a la observada en S. aureus cultivado en medios con yema de huevo. B. cereus no fermenta el manitol por lo que sus colonias son pálidas, con una coloración púrpura del agar que las rodea, mientras que las bacterias fermentadoras del manitol dan unas colonias amarillas.
Son bacterias Gram positivas, familia bacillaceae
Aerobio y anaerobio facultativo
Esporulado: las esporas son centrales, forma elipsoide y al formarse en el interior de la célula dan lugar al hinchamiento de esta.
Crecen entre los 10° - 48º C, la temperatura óptima es entre 28° - 35º C.
Generalmente son móviles con flagelos perítricos.
Poseen antígenos somáticos y flagelares y de esporas.
Las reacciones serológicas no se usan en su identificación, ya que dan reacciones cruzadas con otros géneros.
Los antígenos de las esporas son termoresistentes al igual que las propias esporas
pH = 4,9 - 9,3; Aw = 0,93 - 0,95.
Para la germinación en el momento que se agota el medio, al final de la fase exponencial ocurre la esporulación porque son menos exigentes. La germinación de las esporas es a 30º. Las esporas son moderadamente resistentes al calor. Resisten 100º durante 5-10 minutos.
Ubicuo
Se puede aislar frecuentemente de alimentos naturales e industrializados
Cuando se ingiere en cantidades pequeñas no produce clínica aparente
Se empezó a asociar a alimentos en los años 50.
En los casos de intoxicación los alimentos pueden haber sido tratados pero si se dejan enfriar a temperatura ambiente pueden germinar las esporas, conviene enfriar con rapidez y conservar a temperatura de refrigeración.
En la leche es frecuente que lleguen a las ubres de las vacas y si estas no son esterilizadas antes del ordeño pueden pasar a la leche, se produce la posterior germinación de las esporas y alteran la leche lo cual puede ser detectado.
Alimentos que pueden estar implicados: pasteles con crema, carnes y verduras, sopas, salsas, ensaladas, arroz hervido. Su poder patógeno se fundamenta en:
Toxina emética, enterotoxina, la parte activa es una sustancia de bajo peso molecular (10.000), es estable al calor (resiste 120º C durante 1 hora)
Factor del asa ileal de conejo, enterotoxina diarreica, proteína de peso molecular 38.000 – 50.000, se inactiva por calentamiento a 56º C durante 5 minutos, es termolábil.
Como cuadro clínico clásico de intoxicación, tendremos:
Síndrome emético, náuseas y vómitos se producen al cabo de 1 – 5 horas, la diarrea no es tan frecuente.
Síndrome diarreico, período de incubación de 8 a 10 horas, dolor abdominal y diarrea, la clínica desaparece a las 12 – 24 horas.
Evitar que se multipliquen en los alimentos
Cocinar los alimentos antes de servirlos
Enfriarlos rápidamente y refrigerar
Control en los platos preparados
"SOMOS LO QUE HACEMOS REPETIDAMENTE. EXCELENCIA, POR LO TANTO, NO ES UN ACTO SINO UN HÁBITO"
ARISTOTELES
LEGALES: El autor no asume responsabilidad alguna por la descarga, copia, distribución, modificación o alteración de los contenidos publicados, sean propios del mismo o de terceros, los cuales pudieren estar protegidos por Copyright, Derechos de Propiedad Intelectual, Derechos de Autor, o relacionados. La Bibliografía del tema expuesto y el crédito fotográfico está en poder del Autor y no se publica dada su extensión, pero se enviará por mail al interesado que la solicitare debidamente fundamentada.







.jpg)