Criptosporidiosis (cie-10 a07.2)
Es una enfermedad emergente. Los primeros casos fueron descritos en 1976 y desde mediados de la década del "80, han ocurrido epidemias transmitidas por agua en distintas comunidades. Cryptosporidium parvum, coccidio del subreino Protozoa es el causante. Se han identificado dos genotipos: el 1 (o humano) exclusivamente del hombre y de los primates no humanos y el 2 en el ganado y el hombre, lo que podría indicar que serían dos especies con ciclos exclusivos de transmisión. La dosis infectante es baja (hasta un quiste) y en promedio 132.
Tiene distribución universal. La mayor ocurrencia se observa en primavera lo cual estaría relacionado con el aumento de las precipitaciones y la posibilidad de contaminación de las fuentes de agua. Ha sido encontrado en el 87 % de las muestras de agua en los Estados Unidos y Canadá. La infección se adquiere por vía oral y es de origen fecal. Puede proceder de personas infectadas que contaminan a través de manos, contaminación oro-anal, aguas, hortalizas, etc. La infección también puede transmitirse por materia fecal de animales que sufran la parasitosis. Los animales reservorios son muchos, por lo cual se considera una zoonosis frecuente. Los ooquistes son muy resistentes a las condiciones del medio ambiente y pueden sobrevivir en el suelo por varios meses.
Pueden resistir algunos desinfectantes comunes, pero pierden su viabilidad con la congelación y la ebullición. Se considera la quinta causa de diarrea en niños inmunocompetentes y la prevalencia en la población infantil ha variado de 2% a 30% de acuerdo a los países y a las condiciones higiénicas de las poblaciones estudiadas.
En Colombia se ha encontrado 4% de positividad en niños con diarrea en estudios basados en el examen directo con coloración ácido-resistente, mientras que en México, donde utilizaron inmunofluorescencia con anticuerpos monoclonales, encontraron frecuencias de 9 a 30%. En población general se presentan ocasionalmente brotes o epidemias, debidas a contaminación alimentaria y la incidencia tiene variaciones estacionales o de acuerdo al clima, como se comprobó en Costa Rica, en donde la frecuencia en niños con diarrea aumentó de 4% a 15% entre mayo y agosto, la época caliente y lluviosa. Se considera una de las causas de la diarrea de los viajeros.
Con estudios seroepidemiológicos en la población, se detectan anticuerpos y se han encontrado frecuencias de 25% a 35% en Estados Unidos y de más de 50% en América Latina y en China. La relación epidemiológica más importante es que se ha encontrado en portadores de VIH y en pacientes con SIDA. En ambos casos el parásito se comporta como un agente invasor oportunista. Se calcula que en países desarrollados los pacientes VIH positivos son portadores del parásito entre 10% y 15% y en países en desarrollo entre el 30% y el 50%. En pacientes con SIDA en Colombia, el 45.3% de los que tenían diarrea fueron positivos para Cryptosporidium en materia fecal y en Venezuela el 41.3%. En contraste, sólo de 4% a 5% fueron positivos en casos similares de Estados Unidos.
En el año 2000 el número de personas infectadas por VIH en el mundo era de 38 millones y han llegado casi a 40 millones a finales de 2014. Estas cifras alarmantes, que aumentan permanentemente, hacen necesario que se establezcan medidas de control para los agentes oportunistas que ya son más de 100. En pacientes inmunocompetentes la diarrea generalmente es autolimitada y no requiere tratamiento. El problema grave de la diarrea se presenta en los inmunosuprimidos.
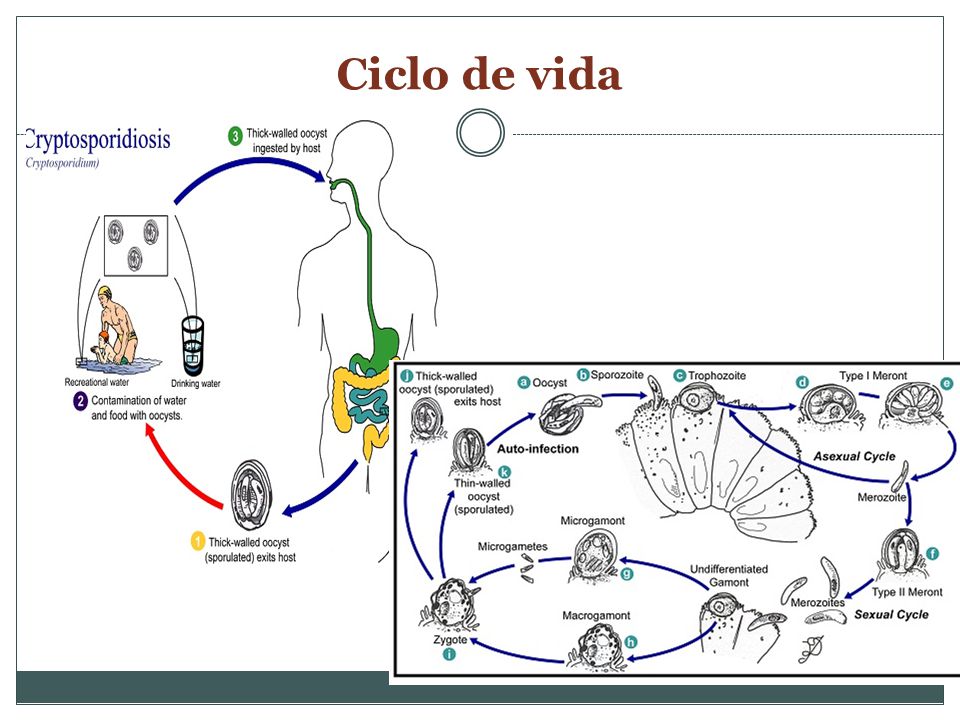
El reservorio primario está constituido por el ganado bovino y animales domésticos y el hombre. La transmisión es por contaminación fecal del agua y los alimentos (vegetales, frutas, leche no pasteurizada), también ocurre de persona a persona y de animales al hombre. Los quistes eliminados son infectantes y se mantienen durante 2-6 meses. Han sido comunicados numerosos brotes que afectaron 415.000 personas desde 1984. El más importante ocurrió en Milwaukee (Wisconsin, Estados Unidos) con 403.000 personas con diarrea. La modificación del estándar de turbidez del agua potable (Menos de 0,17 unidades nefelométricas), sin embargo, no impidió el brote de Las Vegas.
Un siglo después de su descubrimiento y después de casi tres décadas de intensas investigaciones, Cryptosporidium sigue siendo, en muchos aspectos, un enigma. Perteneciente al phylum Apicomplexa, posee como otros coccidios entéricos de vertebrados un ciclo de vida monoxeno que se completa primariamente en el tracto gastrointestinal de un solo huésped. Sin embargo, posee características únicas que lo distinguen de otros coccidios.
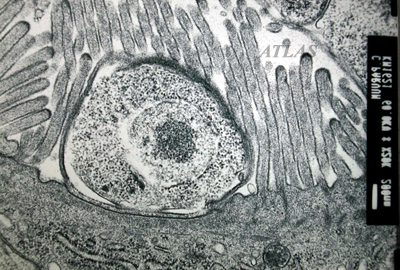
La localización peculiar dentro de la célula huésped, intracelular pero extracitoplasmática, que confina los estadios de desarrollo endógeno a la superficie apical de las células epiteliales; la unión del parásito a la célula huésped a través de una organela multimembranosa en la base de la vacuola parasitófora que facilita la incorporación de nutrientes desde la célula huésped; la presencia de dos tipos morfofuncionales de ooquistes, los de paredes gruesas que son excretados, y los de paredes delgadas, responsables de la iniciación del ciclo autoinfectivo en el huésped infectado; el tamaño pequeño de los ooquistes que carecen de estructuras morfológicas tales como micrópilo, esporoquistes y gránulos polares y, finalmente la insensibilidad a todos los agentes anticoccidiales probados.
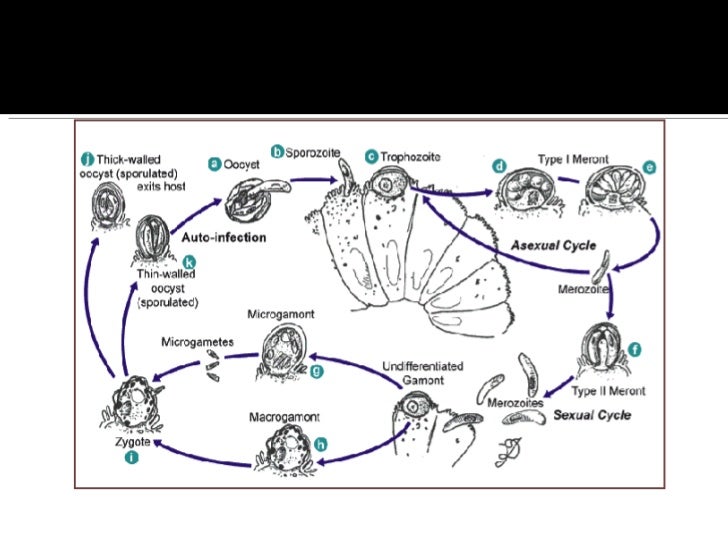
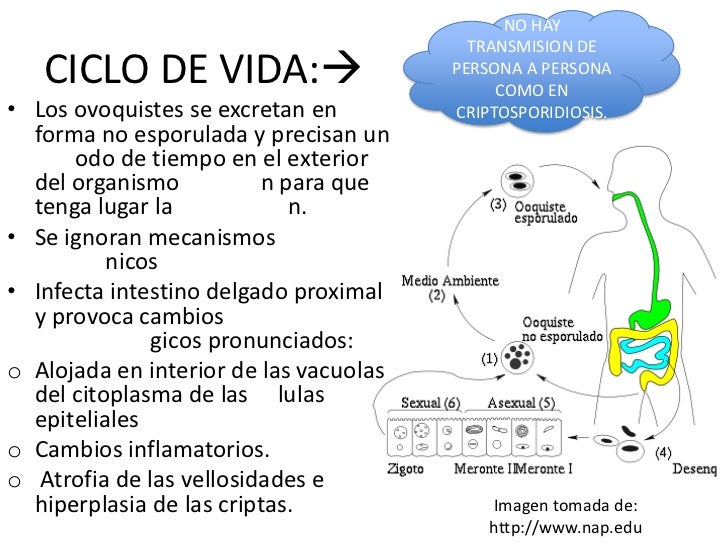
Los coccidios del género Cryptosporidium tienen un ciclo de vida monoxeno pues todas las etapas de su desarrollo (sexual y asexual) se completan dentro del tracto gastrointestinal de un único huésped. Presentan un estadio exógeno que corresponde a los ooquistes esporulados excretados por las heces de los huéspedes infectados, u otros materiales biológicos como las secreciones respiratorias. El diámetro de cada ooquiste varía entre 4 y 6 ?m. La fase endógena del ciclo comienza una vez que el huésped apropiado ingiere (o inhala) los ooquistes que contienen cuatro estadios haploides o esporozoítos, los cuales escapan a través de una fisura que se abre en la pared del ooquiste. Al parecer las fluctuaciones de pH en el tracto gastrointestinal, las sales biliares, las enzimas pancreáticas y la temperatura favorecen el desenquistamiento, probablemente, a causa del aumento de la permeabilidad de la pared del ooquiste, la movilidad de los esporozoítos dentro del ooquiste y la consecuente exposición de receptores.
El esporozoíto se adhiere a receptores de la membrana apical de la célula epitelial del huésped mediante diversos ligandos, GP900, P23, CP47, entre otros. Este proceso induce la reorganización del citoesqueleto de actina y la protrusión de la membrana de la célula huésped alrededor del esporozoíto para formar una vacuola parasitófora, donde el microorganismo permanece en posición intracelular pero extracitoplasmática.
Dentro de la vacuola, el parásito, que en este estadio recibe el nombre de trofozoíto, comienza un ciclo de multiplicación asexual (esquizogonia o merogonia) y luego continúa con una multiplicación sexual (gametogonia). Durante el ciclo de proliferación asexual se forman merontes de los cuales emergen merozoítos capaces de infectar otras células del huésped, en las que iniciarán otra merogonia o, alternativamente, una gametogonia para diferenciarse en estadios sexuales llamados gamontes (gametocitos). Durante la gametogénesis, los gametocitos masculinos liberan varias microgametas, mientras que los gametocitos femeninos se diferencian en una única macrogameta.
Luego de la fertilización el estadio diploide resultante (zigoto) sufre meiosis, mecanismo que restaura el estado haploide. A partir de aquí se inicia el proceso de esporogonia en el cual el zigoto sufre uno o más ciclos de división mitótica para formar un ooquiste que contiene los esporozoítos infectivos. Si bien se asume que la localización normal en un huésped inmunocompetente es el tracto gastrointestinal, en individuos inmunocomprometidos se han descripto fases extraintestinales en vías aéreas, árbol biliar, hígado, vejiga y páncreas.
Cryptosporidium es un patógeno entérico que desencadena una enfermedad diarreica cuya morbilidad y mortalidad son significativas tanto para los seres humanos como para los animales. El desarrollo de nuevas técnicas moleculares ha permitido identificar a los genotipos C. hominis y C. parvum como aquellos que con mayor prevalencia infectan al hombre. Las rutas de transmisión son múltiples (persona a persona, animales a personas, agua, alimentos, aire) y la enfermedad puede afectar a individuos inmunocomprometidos o no. Es un microorganismo emergente cosmopolita cuya aparición no está limitada a ninguna región geográfica o al grado de desarrollo tecnológico de la misma.
Los procesos de urbanización acelerados, la expansión de la pobreza, las migraciones no controladas de gran número de refugiados, la facilidad y rapidez en los desplazamientos, el movimiento creciente de animales y de productos de origen animal, la falta de saneamiento ambiental, son algunos de los factores que, sumados a la escasez de normas legales regulatorias, han posibilitado la dispersión de la enfermedad. La resistencia a los antibióticos incrementa las tasas de morbilidad y mortalidad y los gastos de atención médica asociados con el control de brotes epidémicos. La criptosporidiosis, entonces, representa una amenaza de alcance mundial que exige una respuesta coordinada de los servicios de salud pública de todos los países.
Los quistes ingeridos se localizan en el tubo digestivo (desde la faringe al recto) con mayor frecuencia en el intestino delgado (yeyuno). Se ubican en el glicocálix del enterocito donde se desenquistan y cada uno elimina cuatro esporozoítos que invaden las células epiteliales. Allí cumplen un ciclo asexuado y otro sexuado que resulta en el ooquiste infectante eliminado a la luz intestinal. El parásito en las microvellosidades determina la malabsorción de nutrientes y la retención de agua en la luz intestinal lo que desencadena la diarrea osmótica. Además es la causa del edema y la atrofia de las vellosidades lo que resulta en una disminución de la superficie de absorción. Las heces humanas son infectantes a partir de los 5 - 21 días de la infección.
El período de incubación es de 1 a 21 días (promedio 7). Cursa con una diarrea aguda secretora (puede ser mayor de 3 litros/día) con importante pérdida de electrolitos, dolor abdominal difuso, borborigmos, náuseas, vómitos, hiporexia y pérdida de peso. Las heces son líquidas, abundantes, oscuras, malolientes y en un promedio de 6 / día. En las personas inmunocompetentes la enfermedad dura 3-27 días (se autolimita) y en los inmunocomprometidos mas de 1 mes, pudiendo llevar a la caquexia y la muerte.
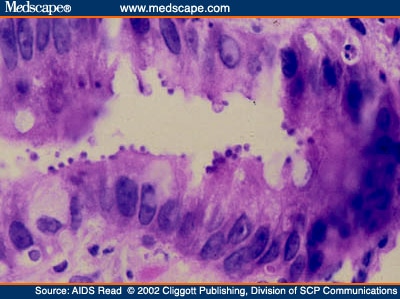
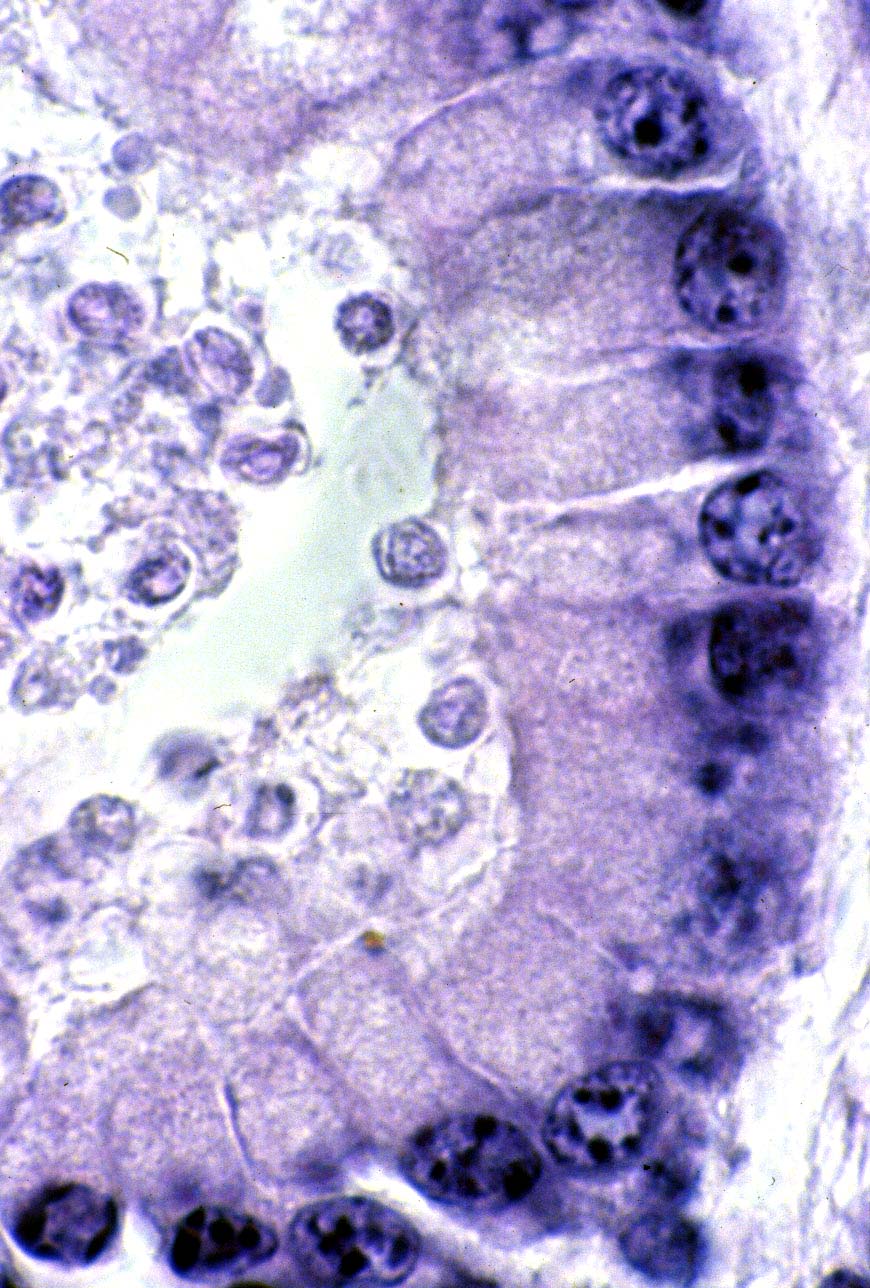
Las lesiones histológicas asociadas con la criptosporidiosis intestinal no son características. El contacto inicial entre el parásito y el glicocálix de la célula huésped, produce un acortamiento o ausencia de las microvellosidades, con atrofia y aumento de tamaño de la cripta. Se observa en la mucosa y hasta la lámina propia un infiltrado moderado de células mononucleares. El yeyuno es la localización intestinal en donde existe mayor infección. Se ha encontrado diseminación en pacientes inmunosuprimidos, principalmente con SIDA, a faringe, esófago, estómago, duodeno, ileum, colédoco, apéndice, colon, recto y pulmones, en cuyo caso pueden encontrarse los ooquistes en el esputo.
En las personas inmunocompetentes, el período de incubación varía entre 3 y 12 días. La sintomatología puede fluctuar entre la sensación de indigestión y un cuadro de enteritis con diarrea de tipo agudo o crónico. Algunas personas pueden tenerla infección totalmente asintomática. En otras aparece la diarrea pero la infección se autolimita. Algunos autores la asocian con el síndrome conocido como diarrea del viajero. La diarrea generalmente es acuosa, sin moco ni sangre, la mayoría de las veces sin leucocitos. Se presenta con 5 a 10 episodios diarreicos al día, después de un tiempo puede seguirle la constipación. En niños con diarrea intensa o crónica, se puede asociar a deshidratación.
Los pacientes se quejan de dolores abdominales, ocasionalmente fiebre, cefalea, anorexia, vómito y pérdida de peso. Generalmente la enfermedad se autolimita a 10-14 días. En una cuarta parte de los pacientes puede llegar a más de un mes. La mayoría de los casos no requieren tratamiento antidiarreico. Los parásitos desaparecen entre 4 y 6 semanas.
En los pacientes con SIDA, además de la localización intestinal, se ha encontrado diseminación con complicación pulmonar. Causa una neumonía intersticial con intensa tos seca y sibilancias. Se han informado casos de colecistitis, con colestasis, fiebre, dolor abdominal y marcada pérdida de peso. Se han comunicado casos de pancreatitis, laringotraqueítis y sinusitis. La enfermedad es más frecuente en los pacientes con SIDA, pero también ocurre en otras inmunodeficiencias como hipogammaglobulinemia, terapia inmunosupresora, desnutrición, leucemia, linfoma y otros defectos de la inmunidad.
En los pacientes con deficiencias inmunes, los síntomas son más intensos y de larga duración. La diarrea es crónica y ocurre una enfermedad debilitante con malestar, anorexia y fiebre. Hay pérdida de líquidos y electrólitos que pueden causar enfermedad grave o muerte por deshidratación.
El diagnóstico de la criptosporidiosis se hace por el hallazgo de ooquistes en las materias fecales o en material obtenido del duodeno por la cuerda de Beal (Entero tests). En las preparaciones con solución salina y lugol se pueden observar unas estructuras redondeadas u ovoides de pared definida, como "huecos vacíos", de tamaño uniforme, refringentes, algunas veces con estructuras granulares internas, que no son fáciles de identificar. La técnica más precisa es la coloración por el método de Ziehl-Neelsen modificado, sin utilizar el calentamiento de la placa. Se observan los ooquistes ácido-resistentes, de color rojo brillante sobre fondo azul.
En algunos se ven unos corpúsculos internos que corresponden a los esporozoítos. Otras coloraciones que se utilizan son Kinyoun y Giemsa. Para concentrar ooquistes de Cryptosporidium se realizan las técnicas de Ritchie modificada que usa formol-éter y la de Sheather que es una flotación con azúcar. Ambas son similares en efectividad. Es necesario tener precaución en la manipulación de muestras de pacientes con SIDA.
La identificación de los ooquistes también se hace con inmunofluorescencia directa, para la cual hay estuches comerciales. Existen también estuches para identificar antígenos específicos de Cryptosporidium por métodos inmunoenzimáticos. Se han comparado los 3 métodos diagnósticos más utilizados: visualización de los ooquistes con Ziehl-Neelsen o con inmunofluorescencia y la identificación de antígenos por ELISA en materia fecal y se ha encontrado que todos tienen sensibilidad y especificidad de 96% a 98%, por lo cual la escogencia depende de las posibilidades de los laboratorios y de los costos de los reactivos.
En biopsia intestinal se puede observar la atrofia de las vellosidades del intestino y la hipertrofia de las criptas, en donde se localiza el parásito. Se logran definir distintos estadios mediante las coloraciones comunes de hematoxilina - eosina, en donde se ven de color violeta. También se usa la técnica de plata - metenamina, Giemsa, Kinyoun y la inmunoperoxidasa. Es posible también demostrar anticuerpos circulantes con inmunofluorescencia indirecta y con técnicas de ELISA. En los estudios serológicos se consideran significativos para el diagnóstico los títulos de 1:40 o superiores. Análisis de alimentos y otras muestras: Investigación de ooquistes por microscopía, uso de técnicas de biología molecular.
El tratamiento de base, apunta a un equilibrio del aporte hidroelectrolítico (reposición de pérdidas) y de nutrientes. Se ha logrado una eficacia del 50 % en el tratamiento de los adultos con 2-3 g/día de espiromicina durante 7-30 días.
Las medidas de prevención y control estarán basadas en las básicas para casi todas las EPTA(s):
Eliminación sanitaria de excretas.
Provisión de agua segura (filtrada para eliminar partículas de 0,1-1 um).
Educación para la salud.
Los quistes son inactivados por calentamiento a temperatura de 72ºC durante un minuto o 45ºC durante 10-20 minutos o por congelación.
Cycloporiasis o Ciclosporiasis(cie-10 a107.8)
Es una enfermedad diarreica emergente con frecuencia en aumento, particularmente en los meses de temperaturas cálidas. Fue descripta en 1977. Cyclospora cayetanensis es un parásito unicelular coccidio, de 8-10 µ de diámetro. La especie fue designada en 1994, previamente se la denominó cianobacteria o cuerpo tipo coccidio. Es una de las parasitosis humanas que se descubrió recientemente, similar a criptosporidiosis en su agente etiológico y en sintomatología. Cyclospora cayetanensis (C. cayetanensis) es un protozoo patógeno emergente causante de enfermedad diarreica. Esta coccidia era referida, por desconocerse su ubicación taxonómica, como cuerpos similares a cyanobacteria o formas grandes de Cryptosporidium.
Fue después de los estudios realizados por Ortega et al. que se conoció su clasificación taxonómica. Estos investigadores después de inducir la esporulación con solución de dicrómato de potasio a los conocidos como "cuerpos similares a cyanobacterias" procedentes de casos clínicos, demostraron que el microorganismo contenía por cada ooquiste, dos esporoquistes y dentro de cada uno de ellos dos esporozoítos. Las características de los esporozoítos observadas al microscopio electrónico mostraron organelos característicos de los protozoos coccidias (Phylum Apicomplexa). Fue así como después de identificar que pertenecían al género Cyclospora, se propuso la nomenclatura a la especie como cayetanensis, por ser este el nombre de la Universidad de Lima, Perú (Universidad Cayetano Heredia) donde se llevaron a cabo las investigaciones.
Si bien la infección por este parásito llamó la atención a la ciencia por estar asociada a diarrea del viajero, adquirió una mayor relevancia en los primeros años de la década de los 90, cuando se notifica su asociación con diarreas en pacientes con Síndrome de Inmunodeficiencia Adquirida (SIDA). Adicionalmente, esta coccidia comenzó a verse relacionada con la ingestión de frambuesas contaminadas. Cyclospora spp. afecta a animales y al hombre. Ha sido comunicada en numerosos países, siendo más común en las regiones tropicales y subtropicales. Los ooquistes son eliminados con las heces y esporulan en el medio ambiente en alrededor de dos semanas a temperaturas de 22º a 32º C. La transmisión ocurre por la contaminación fecal de agua y alimentos. La susceptibilidad es universal.
Han ocurrido brotes internacionales, desde 1990, que afectaron aproximadamente a 3600 personas en los Estados Unidos y Canadá. Los alimentos fueron frambuesas (procedentes de Guatemala), perejil y lechuga. Los brotes tienen un patrón estacional con predominio en los meses cálidos.
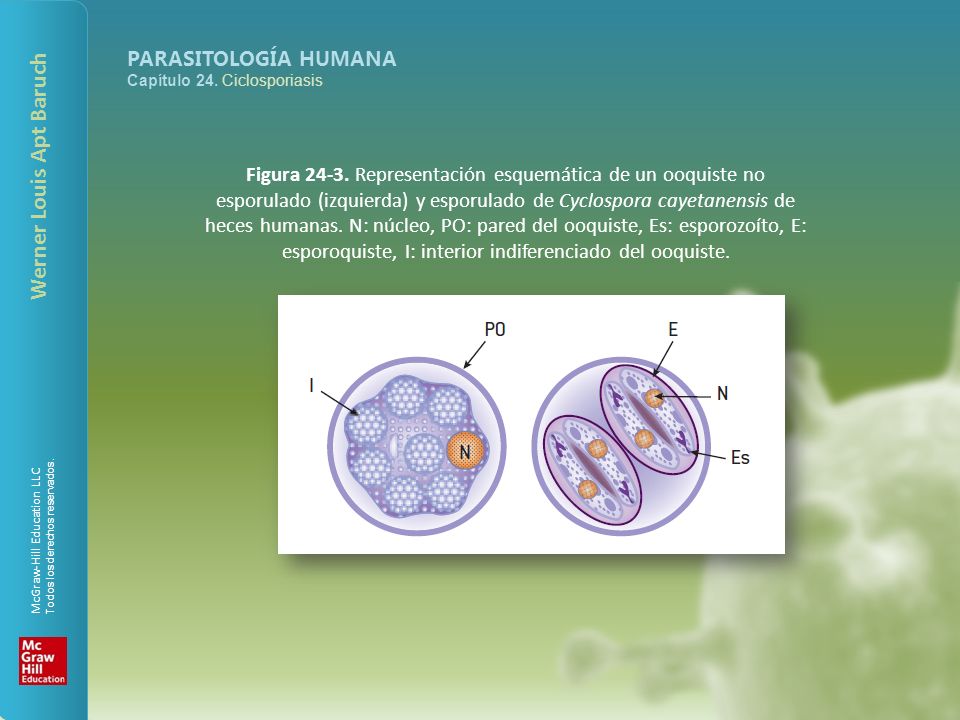
Cyclospora es un género en el Phylum Apicomplexa, de esta manera el parásito se relaciona íntimamente con otros cuatro agentes biológicos dentro del grupo coccidias: Cryptosporidium, Isospora, Toxoplasma y Sarcocystis. Se puede distinguir de otras coccidias por su tamaño, forma y número de esporoquistes y esporozoítos. Los ooquistes de C. cayetanensis, hasta el presente la única especie que se reporta en el humano, son esféricos, con doble pared y miden de 8 a 10 ?m de diámetro; son algo más pequeños que los ooquistes de Cyclospora descritos en hospederos no humanos. Al examinar las heces en fresco que contienen ooquistes de C. cayetanensis, estos se ven como esferas hialinas (figura). En su interior presentan una mórula de color verdoso con varios glóbulos refringentes que se disponen a modo de racimo o roseta. Cuando esporula, en su interior se encuentran dos esporoquistes, cada uno con dos esporozoítos. En heces viejas o preservadas, se ven pocos glóbulos en su interior.
Como los ooquistes de Cryptosporidium e Isospora, son ácido-alcohol resistentes. El ciclo de vida de Cyclospora cayetanensis no ha sido totalmente dilucidado. La presencia de ooquistes en heces sugiere que el ciclo sexual y el asexual pueden desarrollarse en el hospedero humano. Su localización es intracitoplasmática, dentro de una vacuola parasitófora en la región apical supranuclear de las células epiteliales del intestino delgado; allí se reproduce y se multiplica. Al salir al exterior con las heces los ooquistes no están esporulados. Requieren de tiempo fuera del hospedero para su esporulación y convertirse en infecciosos, por tanto la transmisión de persona a persona no es probable. El tiempo requerido para la esporulación en la naturaleza no es conocido.
En el laboratorio los microorganismos en condiciones óptimas de laboratorio esporulan dentro de las primeras dos semanas de excretados. Se plantea que la forma infectante llega a un nuevo hospedero susceptible a través del agua y los alimentos contaminados. La incidencia y prevalencia de la infección por Cyclospora cayetanensis se desconocen, en parte por la pobre asistencia a las consultas médicas de las personas con cuadros diarreicos, la poca sensibilidad de las técnicas diagnósticas disponibles, el número reducido de ooquistes que aparece en las heces del paciente, unido al poco uso de técnicas de concentración para protozoos en los laboratorios, así como la poca indicación de realización de la técnica de Ziehl-Neelsen y la inexperiencia de muchos de los laboratoristas para identificar los ooquistes de Cyclospora.
Sin embargo, esta infección está siendo reportada en forma creciente en numerosos países a escala mundial, incluyendo Guatemala, Venezuela, Nueva Guinea, Cuba, Brasil, EUA, Canadá, Haití, Colombia y Turquía, Perú, Vietnam, Nepal, Egipto, entre otros. Esta información, en la mayor parte de las notificaciones, proviene de estudios realizados en viajeros internacionales, inmunodeprimidos y escolares.
En el continente americano se han realizado múltiples reportes de esta infección. En Guatemala, al estudiar personas de diferentes localidades se encontró que el 2,3% de la muestra estudiada, entre adultos y niños, estaban infectados por esta coccidia. En Venezuela, entre la población indígena de San Antonio de Morichal se encontró que entre las coccidias, esta fue la más prevalente alcanzando hasta un 11,9%. En Cuba se encontró en un estudio en inmunodeprimidos por SIDA que el 3% estaban infectados y en un estudio realizado entre escolares de una zona urbana se demostró la presencia de Cyclospora en 0,7% de los niños estudiados, algo menor de lo encontrado en cuatro guarderías infantiles, donde se encontró un 1,5% de infectados. Cifras superiores se encontraron entre niños ingresados en un hospital pediátrico, donde el 3,7% de los ingresados en los servicios de atención a pacientes con diarrea estaban infectados por este protozoo.
La transmisión de persona a persona no ha sido documentada. Se reconoce que debe pasar un tiempo fuera del hospedero, hasta el presente desconocido, para que esporule y de esta forma sea infectante. Cyclospora es transmitida por la ingestión de ooquistes esporulados, los cuales aparecen como resultado de la contaminación fecal de las aguas y los alimentos. En un brote hospitalario reportado en Chicago, la exposición a aguas contaminadas fue implicada en la aparición de la enfermedad. Los ooquistes de Cyclospora son probablemente, junto con los de otras coccidias, uno de los de más alta resistencia a la desinfección por cloro.
La posibilidad de la transmisión de Cyclospora por alimentos contaminados ha sido comentada, basada en los datos epidemiológicos obtenidos durante diversas investigaciones de brotes en los Estados Unidos de América y Canadá. Tres tipos de productos frescos: frambuesas frescas, lechuga y albahaca han sido implicados como vehículo de infección. Las frambuesas frescas importadas de Guatemala se han asociado con brotes así como las congeladas a -3,3ºC.
Los brotes de transmisión por alimentos resaltan la necesidad de fortalecer las medidas de control y de prevención para asegurar que los productos alimentarios que se comen crudos estén libres de Cyclospora cayetanensis, además de la necesidad de continuar investigando sobre la biología y la epidemiología de esta coccidia También se ha reportado la presencia de portadores sanos, especialmente en países donde la infección es endémica.
La influencia del clima en la infección ha sido vista en muchos países, a pesar de los diferentes tipos de climas. Aunque se desconocen las causas, se piensa guarde relación, en parte, a la fluctuación de temperatura y humedad. En Guatemala, en un estudio hecho en un año de vigilancia a pacientes ambulatorios, mostró que la infección era más frecuente en primavera, entre los niños de 1 a 9 años y en las personas con gastroenteritis. En Turquía, fue más frecuente en el verano y otoño. En la actualidad quedan muchas interrogantes sobre esta parasitosis donde factores relacionados con Cyclospora cayetanensis, con el ambiente y con el susceptible quedan por esclarecer.
Se han encontrado o








%2017%2020.jpg)